
如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1 mol A、3 mol B发生可逆反应:A(g)+3B(g)  2C(g)+D(s),下列说法正确的是( )
2C(g)+D(s),下列说法正确的是( )
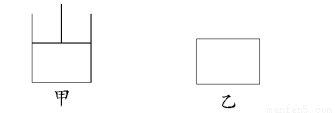
A.当乙中混合气体总质量不再变化时即达到化学平衡
B.达平衡时用A表示反应速率时,v(甲)<v(乙)
C.由于容器甲的容积在不断变化,故从反应开始到平衡所需时间比容器乙要长
D.达到平衡时,甲所需时间短,但两容器中A的转化率相等
 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
用下图所示装置检验乙烯时不需要除杂的是( )
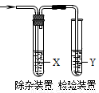
乙烯的制备试剂X试剂Y
ACH3CH2Br与NaOH乙醇溶液共热水Br2的CCl4溶液
BCH3CH2Br与NaOH乙醇溶液共热水KMnO4酸性溶液
CC2H5OH与浓H2SO4NaOH溶液KMnO4酸性溶液
DC2H5OH与浓H2SO4NaOH溶液Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
(2012年石家庄市质检)下列有机反应属于同一反应类型的是( )
A.甲烷制一氯甲烷、苯制硝基苯
B.苯制溴苯、乙烯制乙醇
C.乙醇制乙醛、乙醇和乙酸制乙酸乙酯
D.苯制环己烷、乙酸乙酯水解
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸
B.将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半
C.常温下,某溶液中由水电离出的c(OH-)=1×10-10mol/L,该溶液可能是盐酸
D.如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
合成氨尿素工业生产过程中涉及的物质转化过程如下图所示。
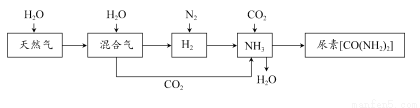
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为___________________________________。
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:___________。
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
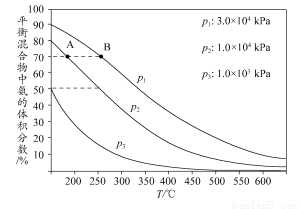
①若分别用vA(NH3)和vB(NH3)表示从反应开始至平衡状态A、B时的化学反应速率,则vA(NH3)________vB(NH3)(填“>”、“<”或“=”)。
②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
③在250°C、1.0×104kPa下,H2的转化率为________%(计算结果保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
温度为T℃,压强为1.01×106 Pa条件下,某密闭容器中发生反应:A(g)+aB(?)  4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
A.第二次平衡时B为气态
B. a>3
C.第一次平衡后增大压强平衡向左移动
D.第三次达到平衡时B为非气态
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
下列有关化学平衡图像描述正确的是( )
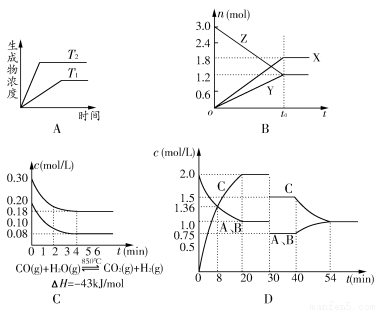
A.图像A代表任何可逆反应中生成物浓度随温度的变化关系图
B.图像B表示反应的化学方程式为:2Z(s)  3X(g)+2Y(g)
3X(g)+2Y(g)
C.图像C代表在10 L容器、850℃时反应,到4 min时,反应放出51.6 kJ的热量
D.图像D代表等物质的量的气体A和B,在一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,其在20~40 min之间的平衡常数不相等
2C(g),达到平衡后,只改变反应的一个条件,其在20~40 min之间的平衡常数不相等
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-=X+2H+。下列说法中正确的是 ( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e-+2H2O=4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2=2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
把一块镁铝合金投入到1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说法中错误的是( )
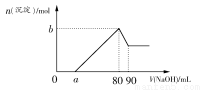
A.盐酸的体积为80 mL
B.a的取值范围为0<a<50
C.n(Mg2+)<0.025 mol
D.当a值为30时,b值为0.01
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com