
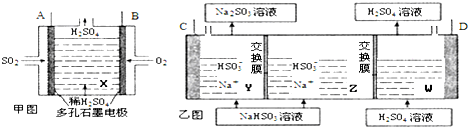
分析 (1)电解NaHSO3溶液制取H2SO4,阴极是水电离氢离子放电生成氢气,得到的氢氧根离子与亚硫酸氢根离子反应得到亚硫酸根,所以乙图C极为阴极,D为阳极,Na+向阴极区移动;
(2)乙图C极为阴极得电子发生还原反应.
解答 解:(1)电解NaHSO3溶液制取H2SO4,阴极是水电离氢离子放电生成氢气,得到的氢氧根离子与亚硫酸氢根离子反应得到亚硫酸根,所以乙图C极为阴极,D为阳极,则甲图中B为正极与乙图D相连,Na+向阴极Y区移动,故答案为:D;Y;
(2)乙图C极为阴极得电子发生还原反应,反应式为2HSO3-+2e-═2SO32-+H2↑,故答案为:2HSO3-+2e-═2SO32-+H2↑.
点评 本题涉及原电池、电解原理的考查,为高频考点,需要学生具备扎实的基础与分析解决问题的能力,注意把握二氧化硫的性质以及原电池、电解池的工作原理以及电极方程式的书写,难度较大.


科目:高中化学 来源: 题型:填空题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅与金刚石分子都是正四面体结构 | |
| B. | 硅酸盐都不溶于水? | |
| C. | 硅与酸、碱都不能发生反应 | |
| D. | 原硅酸和硅酸对应的酸酐都是二氧化硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com