
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101 kPa)下的气体摩尔体积。拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为A、_____________。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中,一段时间后稀硫酸不能顺利滴入锥形瓶中,其原因是____________________。
(3)金属铝与稀硫酸反应的离子方程式为_________________。
(4)实验结束时,测量实验中生成H2体积的操作方法是_______________。
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V ml。。则通常状况下气体摩尔体积Vm=__________L·mol-l。若合金中含少量铜,则所测得的Vm将____________(填“偏大”“偏小”或“无影响”)。
【答案】(1)E、D、G(2分)
(2)铝与稀硫酸反应生成气体且放热,使锥形瓶内压强增大(2分)
(3)2Al+6H+=2Al3++3H2↑(2分)
(4)待实验装置冷却至通常状况后,上下移动量筒使其中液面与广口瓶内液面相平,再平视读取量筒中水的体积,即所产生的H2在通常状况下的体积(2分)
(5)9V/500(m1m2) LmoL-1(3分);无影响(2分)
【解析】
试题分析:1)①装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:E、D、G;(2)镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;答案为:铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;(3)根据气压原理,待实验装置冷却后,上下移动量筒使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,此时的体积即为常温常压下的体积,即氢气在通常状况时的体积,故答案为:待实验装置冷却后,上下移动量筒使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积;(4)实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,则金属铝的质量是m1-m2,实验后量筒中液面读数为VmL,即产生的气体物质的量是V×10-3/VM根据化学反应原理: 金属铝与硫酸反应,硅与硫酸不反应;
2Al~~~~~~3H2↑
2 3
(M1-m2)/27 V×10-3/VM
Vm=18V/1000(m1m2)LmoL-1 =9V/500(m1m2) LmoL-1
若合金中含有金属铜,不会和硫酸之间反应,和含有硅是一样的结果,无影响.


科目:高中化学 来源: 题型:
【题目】下列关于微量元素和大量元素的说法,正确的是( )
A. 都属于生命活动的必需元素
B. 都属于生命活动的主要元素
C. 前者是细胞特有的,后者是细胞与非生物界共有的
D. 两者都是细胞自身合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,红棕色的NO2可以发生如下反应:2NO2(g)![]() 2NO(g)+O2(g)△H>0,下列叙述中正确的是
2NO(g)+O2(g)△H>0,下列叙述中正确的是
A. 恒温恒容,充入NO2气体,其转化率增大
B. 加压,平衡向逆反应方向移动,混合气体颜色变深
C. 若平衡常数增大,则可能是升高了温度或减小了体系的压强
D. 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
A.该反应的ΔH值与反应物用量无关
B.该反应的化学能可以转化为电能
C.反应物的总能量高于生成物的总能量
D.该反应中反应物的化学键断裂放出能量,生成物的化学键形成吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,用Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO![]() ):n(HSO
):n(HSO![]() )变化关系如下表:
)变化关系如下表:
n(SO | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显____________性,用平衡原理解释:_____________________;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)___________________;
a.c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
b.c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
(2)若某溶液中含3mol Na2SO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HSO![]() 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________mol;
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________mol;
(3)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为 ,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”,CH3OH的体积分数 (填“增大”、“不变”或“减小”);
CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为 ,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”,CH3OH的体积分数 (填“增大”、“不变”或“减小”);
(4)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为 。(已知Ksp(BaSO4)=1.1×10-10)
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟上述过程,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化(Co3+的还原产物是Co2+)。
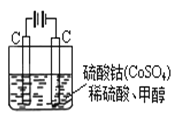
① 写出阳极电极反应式: ;
② 写出除去水中的甲醇的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应在所有温度下都能自发进行,下列对该反应的叙述正确的是( )
A.放热反应,熵增加 B.放热反应,熵减小
C.吸热反应,熵增加 D.吸热反应,熵减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的硫酸铝溶液中加入足量的氨水,过滤得沉淀,将沉淀洗净后灼烧至质量不再变化时冷却、称量,得mg白色固体。原溶液中c (SO42-)为( )
A.![]() mol·L-l B.
mol·L-l B.![]() mol·L-l C.
mol·L-l C.![]() mol·L-l D.
mol·L-l D.![]() mol·L-l
mol·L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+ N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /×10-3 mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO) / ×10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中,不正确的是
A.2s内的平均反应速率υ(N2)=1.875×10-4 mol·L-1·s-1
B.在该温度下,反应的平衡常数K=5
C.若将容积缩小为原来的一半,NO转化率大于90%
D.使用催化剂可以通过提高活化分子百分数提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谷氨酸的R基为-CH2CH2COOH,在一个谷氨酸分子中,含有碳和氧的原子数分别是( )。
A. 4、4 B. 5、4 C. 4、5 D. 5、5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com