
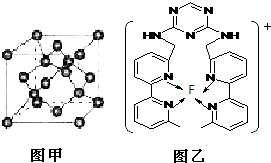
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:| 5+1-2×3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 12 |
| NA |
| 96 |
| NA |
| ||
| ρ g/cm3 |
| 96 |
| ρNA |
| 3 |
| ||
| 3 |
| ||
| ||
| 2 |
| 2 |
| 3 |
| ||
| |||||||
sin
|
| |||||||
sin
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、加水振荡,静置分层后用分液漏斗分离 |
| B、加NaOH溶液振荡后,静置分液 |
| C、加溴水振荡后,过滤 |
| D、加CCl4振荡后,静置分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
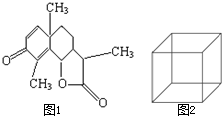 (1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为:
(1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )| A、简单离子的半径大小关系:B>C>E |
| B、D元素的气态氢化物比C元素的气态氢化物稳定 |
| C、由A、B、C三种元素组成的离子化合物NH4NO3中,阴、阳离子个数比为1:1 |
| D、由C、D、E三种元素组成的某种化合物,水解显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com