

分析 有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L,令C的相对原子质量为x,根据电子转移守恒则$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,解得x=24,故C的质子数为24-12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素,E与 A(氧) 同周期且最外层比次外层多3个电子,最外层电子数为5,故E为N元素,据此解答.
解答 解:有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L,令C的相对原子质量为x,根据电子转移守恒则$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,解得x=24,故C的质子数为24-12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素,E与 A(氧) 同周期且最外层比次外层多3个电子,最外层电子数为5,故E为N元素.
(1)A、E氢化物分别为H2O、NH3,由于非金属性O>N,故稳定性:H2O>NH3,故答案为:H2O>NH3;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->O2->Na+>Mg2+,故答案为:Cl->O2->Na+>Mg2+;
(4)由C和D所组成的化合物为MgCl2,用电子式表示形成过程为: ,
,
故答案为: ;
;
(4)D 单质(氯气)与 B 的最高价氧化物对应水化物(NaOH)反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)Cu 与 E 的最高价氧化物对应水化物的稀溶液反应的离子方程式:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O.
点评 本题考查结构性质位置关系的应用,比较基础,推断元素是解题关键,注意元素周期律的理解掌握.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
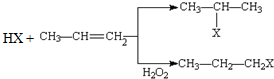 (X为卤素原子)
(X为卤素原子)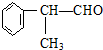 的物质,该物质是一种香料.
的物质,该物质是一种香料.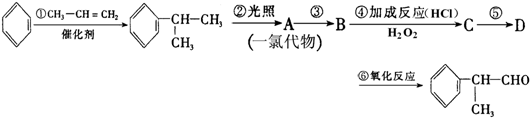
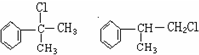 ;
;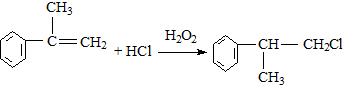 ;
;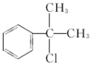 的水解产物
的水解产物 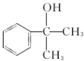 ,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度;
,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度; 等任意一种.
等任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 铜片放入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氯气通入碘化钾溶液中:Cl2+2I-=2Cl-+I2 | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 起始物成质的量/mol | 平衡物质的两/mol | |||
| 容器编马 | CO | Cl2 | COCl2 | COCl2 | |
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 07 |
| A. | 容器I中前5min的平均反应速率v(CO)=0.16mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55mol | |
| D. | 若起始时向容器I加入CO0.8mol,Cl20.8mol,达到平衡时CO转化率大于80%. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
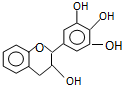 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )| A. | 分子中所有的原子共面 | B. | 1molEGC与3molNaOH恰好完全反应 | ||
| C. | 易发生氧化反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
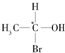 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )| A. | CH3COOH | B. | CH3COCH3 | ||
| C. | 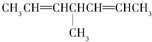 | D. | 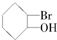 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com