
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
分析 A.0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合得到等浓度的一水合氨和氯化铵混合溶液,溶液PH>7说明一水合氨电离大于铵根离子水解;
B.Na2CO3溶液中存在电荷守恒分析,碳酸根离子水解溶液显碱性;
C.(NH4)2SO4含铵根离子浓度最大,NH4HSO4溶液中氢离子抑制铵根离子水解,NH4Cl溶液中铵根离子水解;
D.0.1mol•L-1(NH4)2Fe(SO4)2溶液中存在物料守恒,氮元素、铁元素守恒.
解答 解:A.0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合得到等浓度的一水合氨和氯化铵混合溶液,溶液PH>7说明一水合氨电离大于铵根离子水解,c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故A正确;
B.Na2CO3溶液中存在电荷守恒分析,碳酸根离子水解溶液显碱性,c(H+)<c(OH-),c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),c(Na+)>2c(CO32-)+c(HCO3-),故B错误;
C.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中,溶质浓度:c(NH4Cl)>c(NH4HSO4)>c[(NH4)2SO4],故C错误;
D.0.1mol•L-1(NH4)2Fe(SO4)2溶液中存在物料守恒,c(NH4+)+c(NH3•H2O)+c(Fe2+)+c(Fe(OH)2)=0.3 mol•L-1 ,故D错误;
故选A.
点评 本题考查了酸碱反应后溶液中离子浓度大小、盐类水解、电解质溶液中电荷守恒和物料守恒的分析判断,掌握基础是解题关键,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2+SO42-;氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 硝酸银与氯化氢溶液反应:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
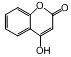 是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )
是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )| A. | 该有机物分子中含有4种官能团 | |
| B. | lmol该有机物最多能与5mol氢气发生加成反应 | |
| C. | 该有机物能与氯化铁溶液发生显色反应 | |
| D. | 该有机物能与氧氧化钠溶液反应,1mol有机物最多消耗2mol氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

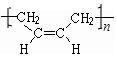 .
.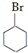 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$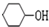 +NaBr.
+NaBr. 制备的合成路线.
制备的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
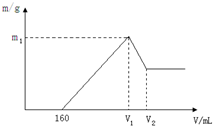 将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com