
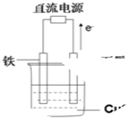
 如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是
如图所示实验装置中,如果起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,此时可观察到的现象是
| ||
| ||


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
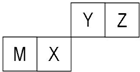
| A、M的离子半径小于Z的离子半径 |
| B、M和Y的最高价氧化物对应水化物之间能相互反应 |
| C、X的单质可以做光导纤维和半导体材料 |
| D、常温下,0.01mol/L的Y的气态氢化物的水溶液的pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氧化铁能与酸反应,可用于制作红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子中C=C双键的键长和乙烷分子中C-C单键的键长相等 |
| B、苯中含有碳碳双键,所以苯属于烯烃 |
| C、乙烯分子里所有的原子都在同一平面内 |
| D、苯可以与溴水、高锰酸钾溶液发生反应而使它们褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com