
| A. | 向相同体积,相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积,可以比较两种一元酸的酸性相对较弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至恰好不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH,可以比较HClO和CH3COOH的酸性强弱 | |
| D. | 在滴有酚酞Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
分析 A.pH相同的一元酸,酸越弱酸的浓度越大,相同体积相同pH的不同一元酸与足量锌反应,酸越弱生成的氢气体积越大;
B.从难溶电解质的溶解平衡的角度分析;
C.次氯酸钠具有漂白性;
D.Na2CO3为强碱弱酸盐,水解呈碱性.
解答 解:A.pH相同的一元酸,酸越弱酸的浓度越大,相同体积相同pH的不同一元酸与足量锌反应,酸越弱生成的氢气体积越大,所以可以根据产生氢气体积相对大小判断酸性强弱,故A正确;
B.硫化银溶解度比氯化银小,在氯化银溶液中加入硫化钠溶液,可生成硫化银沉淀,故B正确;
C.NaClO具有强氧化性,不能用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH,则不能确定pH大小,不能比较酸性的强弱,故C错误;
D.Na2CO3为强碱弱酸盐,水解呈碱性,加入氯化钡生成碳酸钡沉淀,水解程度减小,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及盐类水解、pH测定、难溶物的转化、酸性强弱判断等知识点,明确实验原理及物质性质是解本题关键,侧重考查学生分析能力、实验能力和评价能力的考查,注意把握实验原理,易错选项是C.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | 有3molCl2参加反应,就有6NA个电子转移 | |
| C. | 被还原的氯原子和被氧化的氯原子的个数比是1:1 | |
| D. | 被还原的氯原子和被氧化的氯原子的个数比是5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
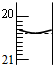 用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:
用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
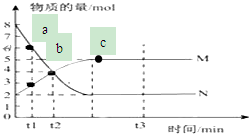 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
.NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.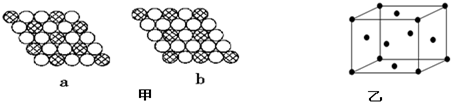
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
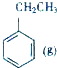 +CO2(g)?
+CO2(g)?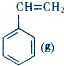 +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com