
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
分析 可以通过增大盐酸浓度、升高温度等方法来改变,但改变条件时不能加入和稀盐酸反应生成氢气的物质,据此分析解答.
解答 解:①滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,且生成氢气量不变,故正确;
②加NaCl溶液,氢离子浓度降低,反应速率减慢,故错误;
③滴入几滴硫酸铜溶液,Fe和铜离子发生置换反应生成Cu,Fe、Cu和稀盐酸构成原电池而加快反应速率,但生成氢气总量减小,故错误;
④升高温度(不考虑盐酸挥发),增大活化分子百分数,化学反应速率增大,且不影响生成氢气总量,故正确;
⑤改用 18.4mol/L的硫酸溶液,浓硫酸和Fe发生钝化现象,导致生成氢气总量减小,故错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,浓度、温度、催化剂、反应物接触面积、压强都是影响化学反应速率因素,注意这些外界条件的适用范围,注意:浓硫酸和Fe、Al易发生钝化现象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
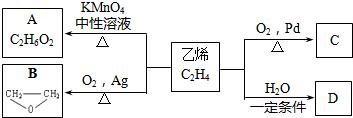
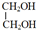 +2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
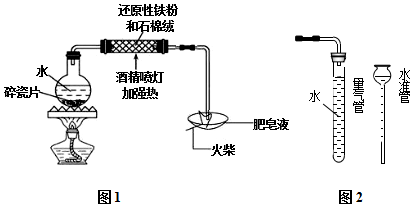
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅熔点高,可制玻璃仪器 | B. | NaHCO3受热分解,可焙制糕点 | ||
| C. | N2化学性质稳定,可作保护气 | D. | 明矾易水解生成胶体,可作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
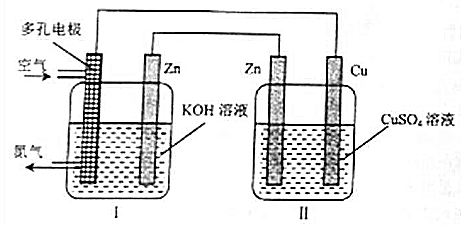
| A. | Cu电极质量增加 | |
| B. | 装置Ⅱ将化学能转变为电能 | |
| C. | 装置Ⅰ中OH-向多孔电极移动 | |
| D. | 多孔电极的电极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1H2O分子所含中子数为8NA | |
| B. | 30g乙烷中所含的共价键数为6 NA | |
| C. | 常温下,1LpH=1的H2SO4溶液中,含有H+的数目为0.2 NA | |
| D. | 100 mL0.1mol•L-1的CuCl2溶液中,含有Cu2+的数目为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
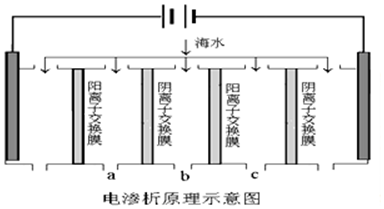
| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com