
| A. | 14C: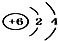 | B. | 16O: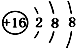 | C. | Li+: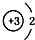 | D. | H-: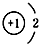 |
分析 元素为质子数相同的一类原子的总称.元素左上角数字为质量数,微粒的结构示意图中,圆圈表示原子核,圆圈内的数值为质子数,核外电子层用弧线表示,弧线上的数据表示每层的电子数,质子数=核外电子数,微粒为原子;质子数<核外电子数,微粒为阴离子;质子数>核外电子数,微粒为阳离子,
A.为碳原子,微粒的结构示意图与微粒符号一致;
B.为氧原子,微粒的结构示意图为硫离子,微粒的结构示意图与微粒符号不一致;
C.为锂离子,微粒的结构示意图与微粒符号一致;
D.为氢元素阴离子,微粒的结构示意图与微粒符号一致.
解答 解:A.14C表示碳元素质量数为14,碳原子核内有6个质子,核外有2个电子层,第一层上有2个电子、第二层上有4个电子,微粒的结构示意图与微粒符号一致,故A正确;
B.16O表示氧元素质量数为16,氧原子核内有8个质子,核外有2个电子层,第一层上有2个电子、第二层上有6个电子,图示微粒结构为硫离子结构,微粒的结构示意图与微粒符号不一致,故B错误;
C.Li+表示锂元素的阳离子,核内有3个质子,核外有1个电子层2个电子,微粒的结构示意图与微粒符号一致,故C正确;
D.H-表示氢元素的阴离子,核内有1个质子,核外有1个电子层2个电子,微粒的结构示意图与微粒符号一致,故D正确;
故选B.
点评 本题难度不大,旨在考查学生对基础知识的掌握,掌握微粒符号的意义、原子结构示意图与离子结构示意图的区别、特点以及元素的核外电子排布规律是正确解答的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl-═Cl2↑+2e- | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu═Cu2++2e- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
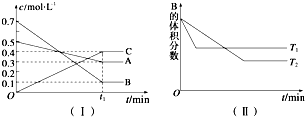
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子数为0.4mol | |
| B. | 磷酸的电离方程式为:H3PO4=H++H2PO4- | |
| C. | 电镀时保持电流恒定,升温可知加快反应速率 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 铁极质量不变 | D. | 铜为原电池正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
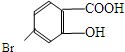 ,它的含氧官能团名称为羧基、羟基.
,它的含氧官能团名称为羧基、羟基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com