
分析 根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律.
解答 解:设加入Cu片的量为xmol,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
xmol 2xmol xmol
CuSO4+Zn═ZnSO4+Cu
xmol xmol xmol
Zn+H2SO4═ZnSO4+H2↑
0.1mol 0.1mol 0.1mol
由Zn溶解,产生Cu质量减轻7.5g可得:65g/mol×(xmol+0.1mol)-64g/mol×xmol=7.5g
∴x=1,
∴加入铜片的质量为m(Cu)=1mol×64g/mol=64g
答:加入铜片的质量为64g.
(2)原 H2SO4的物质的量浓度 c(H2SO4)=$\frac{n}{V}$=$\frac{2×1mol+0.1mol}{0.115L}$=18.3mol/L
答:原硫酸的物质的量浓度为18.3mol/L.
点评 本题考查化学方程式的计算,题目难度中等,注意有关反应方程式的书写,以及题中数据的处理.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何气体在标准状况下所占体积都约是22.4 L | |
| B. | 标准状况时,氧气的体积约是22.4 L | |
| C. | 1 mol任何气体的体积都约是22.4 L | |
| D. | 1 mol氢气和1 mol水含相同分子数,标准状况下体积都约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器中,气体物质的总质量不再变化 | |
| B. | 反应容器中,各物质的量不随时间变化 | |
| C. | 反应容器中,压强不随时间改变而改变 | |
| D. | 反应容器中,气体的密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mL 1.5 mol•L-1的AgNO3溶液 | B. | 10mL 2 mol•L-1的NaCl溶液 | ||
| C. | 5mL 1 mol•L-1的AlCl3溶液 | D. | 5mL 1.6mol•L-1的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | b | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 实验1反应开始到平衡整个过程中转移的电子的物质的量为6mol | |
| B. | 实验2达平衡时,a>7.0 | |
| C. | 实验3温度b>150 | |
| D. | 实验3 CO平衡转化率比实验1小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
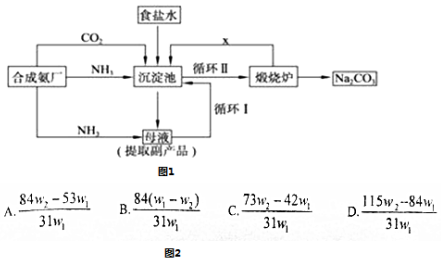
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),下列说法正确的是( )
),下列说法正确的是( )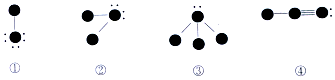
| A. | 四种物质中摩尔质量最大的是③ | B. | ①与③反应生成一种离子化合物 | ||
| C. | ④中含有非极性共价健 | D. | 该四种化合物涉及6种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com