


分析 CO的制备方法:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
(1)①根据装置图可知e的名称;
②为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;
(2)甲酸在浓硫酸作用下脱水生成CO,根据元素守恒和元素守恒可书写化学方程式;
(3)要检验CO中少量S02、C02气体,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,再用品红检验是否除尽,用石灰水检验二氧化碳,所以E1中装置品红溶液,E2中装置酸性高锰酸钾溶液,E3中装品红溶液,F中装澄清石灰水;
(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率;
(5)根据题中物质提纯的流程,粗品中含有正丁醛,利用信息①可知饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;加入乙醚的目的是萃取溶液中的1-丁醇,1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
解答 解:CO的制备方法:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
(1)①根据装置图可知e的名称是分液漏斗,
故答案为:分液漏斗;
②为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压,
故答案为:平衡内外压强,保证液体顺畅流下;
(2)甲酸在浓硫酸作用下脱水生成CO,反应的化学方程式为HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,
故答案为:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O;
(3)要检验CO中少量S02、C02气体,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,再用品红检验是否除尽,用石灰水检验二氧化碳,所以E1中装置品红溶液,E2中装置酸性高锰酸钾溶液,E3中装品红溶液,F中装澄清石灰水,
①根据上面的分析可知,E1的作用是:检验产物是否有S02,E3的作用是检验S02是否除尽,
故答案为:检验产物是否有S02;检验S02是否除尽;
②判断产物中有CO2的现象是E3中品红不褪色,F中石灰水变浑浊,
故答案为:E3中品红不褪色,F中石灰水变浑浊;
(4)由于反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率;正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度;催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短到达平衡所需要的时间,故正确所选项是D,
故答案为:D;
(5)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇;因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,
故答案为:饱和NaHSO3溶液;萃取;蒸馏.
点评 本题考查了气体的制备、有机物的分离、提纯方法、醇的性质以及对基础知识和基本操作的考查,答题时注意把握基础知识和基本实验操作的灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键 | |
| B. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 制造玻璃是复杂的物理变化,玻璃的组成不同,性能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)═AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
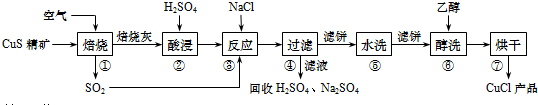
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
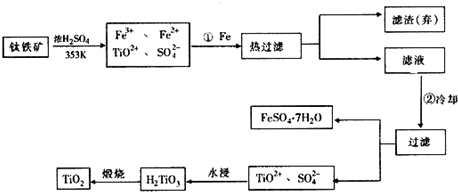
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A的氢化物比元素B的氢化物更稳定 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 原子半径:C>D>B | |
| D. | 元素B的气态氢化物的沸点比元素E气态氢化物的沸点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com