
| A. | -252.9 kJ•mol-1 | B. | +252.9 kJ•mol-1 | C. | -604.5 kJ•mol-1 | D. | +604.5 kJ•mol-1 |
分析 由②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1、
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ•mol-1
结合盖斯定律可知,②×4-①得到CO2(g)+4H2(g)═CH4(g)+2H2O(l),以此来解答.
解答 解:由②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1、
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ•mol-1
结合盖斯定律可知,②×4-①得到CO2(g)+4H2(g)═CH4(g)+2H2O(l),则△H3=(-285.8kJ•mol-1)×4-(-890.3kJ•mol-1)=-252.9 kJ•mol-1,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握已知反应与目标反应的关系为解答的关键,侧重分析与计算能力的考查,注意盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 漂白粉露置在空气中:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用少量氨水吸收二氧化硫:SO2+NH3•H2O=HSO3-+NH4+ | |
| C. | 少量CO2通入苯酚钠溶液:2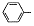 +CO2+H2O→2 +CO2+H2O→2 OH+CO32- OH+CO32- | |
| D. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若t1>t2,则v1>v2 | |
| B. | 甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol C,则甲容器内的反应速率比乙容器内的反应速率快 | |
| C. | 当温度升高时v1增大,v2减小 | |
| D. | 在甲、乙容器中分别加入MnO2,v1、v2不一定加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 将一小粒金属钠投入水和苯的混合体系中,钠在苯与水的界面处反应并可能作上、下跳动 | |
| D. | 某物质灼烧时,焰色反应为黄色,该物质一定只含钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.37 mol | B. | 1.5 mol | C. | 0.63 mol | D. | 0.74 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱 | |
| B. | 石英、水晶、硅石的主要成分都是二氧化硅 | |
| C. | 二氧化硅的化学性质活泼,能与任意的酸、碱发生反应 | |
| D. | 碳族元素的单质都有导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4的摩尔质量为32 | |
| B. | 1 molN2H4的质量为32 g•mol-1 | |
| C. | 在标准状况下,1 mol N2H4的体积约为22.4L | |
| D. | 6.02×1023个N2H4分子的质量为32g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com