
| A. | 元素周期表中位于金属与非金属分界线附近的元素,既表现金属性,又表现非金属性 | |
| B. | 同主族元素的原子,最外层电子数相同,化学性质相似 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价都等于它的族序数 |
分析 A、金属与非金属元素分界线附近的元素,具有金属性与非金属性;
B、同主族元素的单质、化合物具有相似性和递变性;
C、H原子失去电子后没有电子;
D、第三周期元素的最高正化合价等于等于最外层电子数,与主族序数相等.
解答 解;A、金属与非金属元素分界线附近的元素,具有金属性与非金属性,则元素可作半导体材料,故A正确;
B、同主族元素的单质、化合物具有相似性和递变性,化学性质不一定完全相同,如氟气和水反应生成氧气,氯气和水反应生成盐酸和次氯酸,没有氧气生成,故B正确;
C、H原子只有一个电子,当H原子失去一个电子后没有电子,不满足8电子稳定结构,故C错误;
D.第三周期元素的最高正化合价等于等于最外层电子数,与主族序数相等,故D正确;
故选C.
点评 本题考查元素的结构、位置和性质,题目难度不大,明确判断型选择题的解法是:判断是否有反例,如果有反例的为错误,否则正误.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 蔗糖溶液中加入稀硫酸共热,冷却后加入银氨溶液,水浴加热,无银镜产生 | 蔗糖未发生水解 |
| B | 乙醇中加入浓硫酸共热,产生的气体通入溴水,溴水褪色 | 气体为纯净的乙烯 |
| C | 鸡蛋白溶液中分别加入饱和(NH4)2SO4溶液和HgCl2溶液均有白色沉淀 | 蛋白质均发生了盐析 |
| D | 微热含有酚酞的NaHCO3溶液,溶液红色加深 | 盐类水解反应为吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
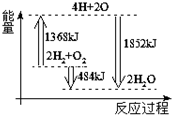
| A. | 由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 | |
| B. | 拆开2mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| C. | 2mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 | |
| D. | 2mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 常温常压下,17g烃基含有的电子总数为9N | |
| C. | 标准状况下,11.2LCH2CI2中含有的共价键数目为2N. | |
| D. | CH2=CH2和CH2=CHCH3的混合气体28g,完全燃烧后生成的CO2分子数目为2.5N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 醋酸跟碳酸氢钠溶液反应:HCO3-+H+═CO2↑+H2O | |
| D. | 乙醇的催化氧化:2C2H5OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
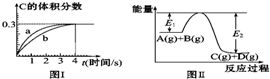
| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com