
| A. | ①③ | B. | ①②⑤ | C. | ②⑤ | D. | ③⑥ |
分析 ①在含大量Fe3+的溶液中不能大量存在和铁离子反应的离子;
②使pH试纸变深蓝的溶液呈强碱性,不能大量存在和氢氧根离子反应的离子;
③水电离的c(H+)=10-13mol/L的溶液呈酸性或碱性;
④在加入铝粉能产生H2的溶液为强碱性或为非强氧化性酸溶液;
⑤使甲基橙变红的溶液呈强酸性;
⑥能使碘化钾淀粉试纸变蓝的溶液具有强氧化性.
解答 解:①在含大量Fe3+的溶液中不能大量存在和铁离子反应的离子,Fe3+、SCN-发生络合反应而不能大量共存,故错误;
②使pH试纸变深蓝的溶液呈强碱性,不能大量存在和氢氧根离子反应的离子,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故正确;
③水电离的c(H+)=10-13mol/L的溶液呈酸性或碱性,强酸性条件下不能大量存在ClO-、CO32-、SO32-,强碱性条件下不能大量存在NH4+,故错误;
④在加入铝粉能产生H2的溶液为强碱性或为非强氧化性酸溶液,酸性条件下,硝酸根离子和铝反应生成氮氧化物而不是氢气,强碱性条件下不能大量存在NH4+、Fe2+,故错误;
⑤使甲基橙变红的溶液呈强酸性,离子之间不反应,所以能大量共存,故正确;
⑥能使碘化钾淀粉试纸变蓝的溶液具有强氧化性,S2-、Br-不能大量共存,故错误;
故选C.
点评 本题考查离子共存,为高频考点,侧重考查复分解、氧化还原反应、络合反应等知识点,明确离子性质及离子反应条件是解本题关键,注意限制性条件的挖掘和运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH3 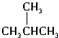 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3 | |
| B. | CH3-CH3 CH2=CH-CH3 CH3CH=CHCH3 | |
| C. | 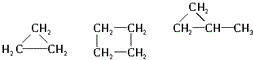 | |
| D. | CH3CH2CH2CH2CH3 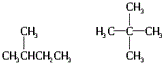 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将某气体通入澄清石灰水中 | 变浑浊 | 该气体一定是CO2 |
| C | 向某溶液中加入2滴KSCN溶液; | 溶液不显红色; | 溶液中一定含有Fe2+ |
| 另取样,先滴入氯水,再滴入KSCN溶液 | 溶液变为红色 | ||
| D | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
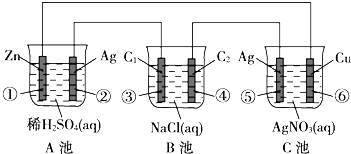 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ②④⑤ | C. | ①③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量碳酸钠固体 | B. | 少量硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com