
| A. | 0.03mol | B. | 0.04mol | C. | 0.05mol | D. | 0.06mol |
分析 60mL 2mol/L的NaOH溶液中含有氢氧化钠的物质的量为:2mol/L×0.06L=0.12mol,所得溶液中只含有2种溶质,溶质组成为:①NaOH和NaCl,②NaCl和NaClO,
当溶质为①NaOH和NaCl时,说明氯气不过量,氯元素完全转化成NaCl,根据氯原子守恒计算出氯气的物质的量,再计算出含有氢气的物质的量;
当溶质为②NaCl和NaClO时,说明氯气过量,氢氧化钠溶液完全反应,生成次氯酸钠的物质的量为0.12mol-0.1mol=0.02mol,根据反应Cl2+2NaOH=NaCl+NaClO+H2O计算出混合气体中与氢氧化钠溶液反应的氯气的物质的量,再结合反应H2+Cl2=2HCl、HCl+NaOH=NaCl+H2O计算出混合气体中氢气的物质的量.
解答 解:60mL 2mol/L的NaOH溶液中含有氢氧化钠的物质的量为:2mol/L×0.06L=0.12mol,
所得溶液中只含有2种溶质,溶质组成为:①NaOH和NaCl,②NaCl和NaClO,
当溶质为①NaOH和NaCl时,说明氯气不过量,氯元素完全转化成NaCl,根据氯元素守恒可知氯气的物质的量为:0.1mol×$\frac{1}{2}$=0.05mol,则氢气的物质的量为0.05mol;
当溶质为②NaCl和NaClO时,说明氯气过量,氢氧化钠溶液完全反应,生成次氯酸钠的物质的量为:0.12mol-0.1mol=0.02mol,根据反应Cl2+2NaOH=NaCl+NaClO+H2O可知混合气体中与氢氧化钠溶液反应的氯气的物质的量为0.02mol,则参与反应H2+Cl2=2HCl、HCl+NaOH=NaCl+H2O的气体的物质的量为:0.1mol-0.02mol=0.08mol,所以氢气的物质的量为:0.08mol×$\frac{1}{2}$=0.04mol;
根据分析可知,氢气的物质的量可能为0.04mol或0.05mol,
故选BC.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 苯酚与碳酸氢钠溶液混合:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O | |
| B. | 向FeBr2溶液中通入等量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl- | |
| C. | 将Al投入NaOH的重水溶液:2Al+2OH-+2D2O→2AlO2-+3D2↑ | |
| D. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
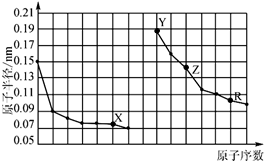
| A. | X、R的最高化合价相同 | |
| B. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| C. | X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1 | |
| D. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 | |
| B. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 | |
| C. | 加热NaOH和少量溴乙烷的混合液后滴加硝酸银,可生成浅黄色沉淀 | |
| D. | 制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯,振荡混合均匀后,保持55℃水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示:
如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 都不行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com