
(14分).A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充
分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
①![]() ; ②
; ② ![]() ;
;
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如下图中的_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
科目:高中化学 来源: 题型:
(每空2分,共14分)A、B、C、D均为含苯环的化合物,且相对分子质量B>A>C,已知有机物A的结构简式为: 
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和 NaHCO3溶液反应的化学方程式______ __________。
(2)①有机物B在浓硫酸存在条件下,相互作用生成一种环状酯(如下图)则有机物B的结构简式为 _。
②等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为___ _____。
(3) 1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,写出含碳原子数最少的C的结构简式_____ ___,写出C与浓溴水的反应的化学方程式 。
(4)D和B互为同分异构体,且知其苯环上连有三个取代基,苯环上的一氯代物只有两种,D不与NaHCO3溶液反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量之比为2∶3,则D的结构简式为 、 。(只写二种)
查看答案和解析>>
科目:高中化学 来源: 题型:
(共14分)A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
填写下列空白:
(1)(3分)物质A是 ,B是 ,B的离子结构示意图为 。
(2)(5分)写出化合物E的电子式: ,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示): 。D溶液可以用来止血,请简单说明其止血原理是: 。
(3)(4分)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是 ,漂白粉常用于自来水的杀菌消毒,原因是(写出反应的化学方程式,并加以适当的文字
说明): 。
(4)(2分)F中加入NaOH溶液,并在空气中放置由白色变为灰绿色最后变成红褐色沉淀的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2010年哈尔滨市第六中学高三第二次模拟考试 题型:填空题
(14分)
Ⅰ.A、B、C、D、E均为可溶于水的固体,组成它们的离子有: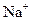 、
、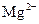 、
、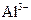 、
、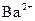 、
、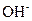 、
、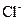 、
、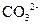 、
、 、
、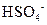 。分别取它们的水溶液进行实验,结果如下:
。分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是:A ;B ;C ;D ;E 。
Ⅱ.有一瓶澄清的溶液,其中可能含有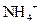 、
、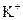 、
、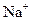 、
、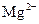 、
、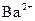 、
、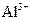 、
、 、
、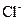 、
、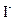 、
、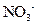 、
、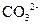 、
、 中的几种。取该溶液进行以下实验:
中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。
(2)取出部分溶液,加入少量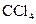 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡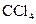 层呈紫红色。
层呈紫红色。
(3)另取部分溶液,逐渐向其中加入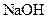 溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入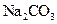 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
(5)根据上述实验事实确定:①该溶液中肯定存在的离子是 ;②还不能确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源:2011届吉林省长春市高三第二次模拟考试(理综)化学部分 题型:填空题
(14分).A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充
分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
① ; ②
; ②  ;
;
③c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A="E " ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如下图中的_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省天水市高一下学期检测化学试卷 题型:填空题
(本题共14分)A、B、C、D 四种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称: ;B在周期表中的位置第 周期,第 族;
(2)A、B形成的化合物为 化合物;(A.离子B.共价)
(3)C的元素符号: ,C的最高价氧化物的化学式: ;
(4) D的最高价氧化物对应的水化物的化学式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com