
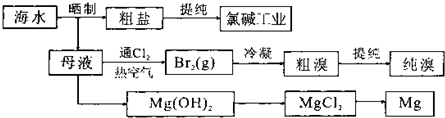
| A、粗盐制精盐需经过溶解、加入沉淀剂、过滤等操作 | B、工业上用电解氯化镁溶液制金属镁 | C、由“母液→MgCl2”一系列变化未涉及氧化还原反应 | D、通入热空气的目的是将生成的溴分离出来 |


科目:高中化学 来源: 题型:阅读理解

| 催化剂 |

| 催化剂 |


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| △ |
| 电解 |
| 2800℃ |
| △ |
| C |
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| 活泼金属 |
| 还原 |
查看答案和解析>>
科目:高中化学 来源:2010年吉林省高一下学期期末考试化学试题 题型:填空题
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。
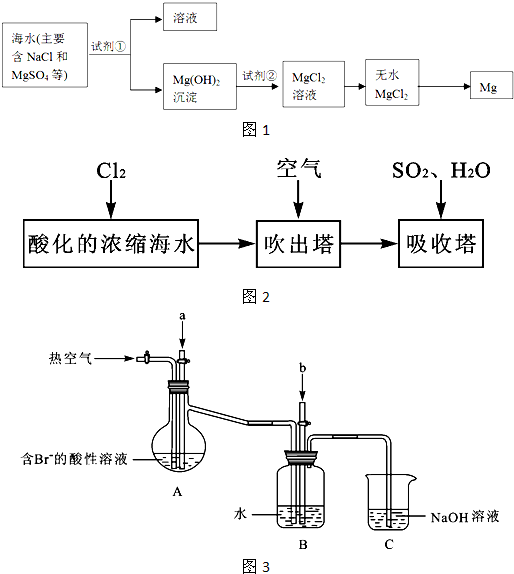
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂①的量应 ;
②试剂②可以选用 ;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是 。
A. B.
B.
C.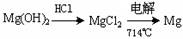 D.
D.
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示) ;
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是 ;
④C装置的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com