
 ;反应类型加聚反应.
;反应类型加聚反应. 分析 (1)乙烯用来衡量一个国家的石油化学工业发展水平;
(2)①乙酸与乙醇发生酯化反应生成乙酸乙酯、水;
②苯乙烯中含碳碳双键,可发生加聚反应生成聚苯乙烯.
解答 解:(1)乙烯用来衡量一个国家的石油化学工业发展水平,故答案为:A;
(2)①乙酸与乙醇发生酯化反应生成乙酸乙酯、水,反应为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,属于酯化反应(或取代反应),
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;酯化反应(或取代反应);
②苯乙烯中含碳碳双键,可发生加聚反应生成聚苯乙烯,反应为 ,属于加聚反应,
,属于加聚反应,
故答案为: ;加聚反应.
;加聚反应.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
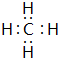 ;
;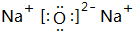 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
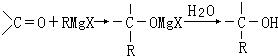
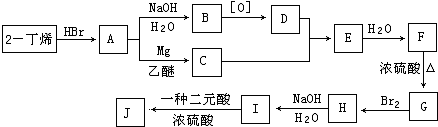
 .
. ,
,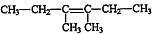 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$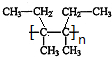 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
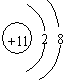 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
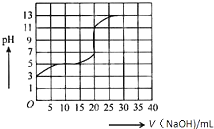 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com