
 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题:分析 (1)2mol二氧化硫反应放出热量为99kJ×2=198kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)①高出反应物能量为活化能,生成物与反应物之间的能量之差为焓变;
②使用催化剂降低活化能,但反应热不变;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,达平衡时测得还有0.04molL-1 SO2剩余,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):1 0.96 0
变化浓度(mol/L):0.96 0.48 0.96
平衡浓度(mol/L):0.04 0.48 0.96
转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:(1)2mol二氧化硫反应放出热量为99.00kJ×2=198.00kJ,热化学方程式为:2SO2(g)十O2(g)?2SO3(g)△H=-198.00 kJ/mo1,
故答案为:2SO2(g)十O2(g)?2SO3(g)△H=-198.00 kJ/mo1;
(2)①高出反应物能量为活化能,生成物与反应物之间的能量之差为焓变;②使用催化剂降低活化能,但反应热不变,如图所示: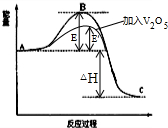 ,
,
故答案为: ;
;
(3)A.随反应进行,气体物质的量减小,恒温恒容下压强减小,容器中气体总压强不变,说明到达平衡,故A正确;
B.混合气体总质量不变,容器容积不变,容器中混合气体的密度始终不变为定值,故B错误;
C.每生成1mol SO3的同时生成1molSO2,而生成1mol SO3的同时消耗1molSO2,二氧化硫的生成速率与消耗速率相等,反应到达平衡,故C正确;
D.平衡时各组分的物质的量关系与起始物质的量及转化率有关,平衡时不一定为化学计量数之比,故D错误,
故选:AC;
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,达平衡时测得还有0.04molL-1 SO2剩余,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):$\frac{2}{2}$=1 $\frac{1.92}{2}$=0.96 0
变化浓度(mol/L):0.96 0.48 0.96
平衡浓度(mol/L):0.04 0.48 0.96
O2的转化率=$\frac{0.48mol/L}{0.96mol/L}$×100%=50%
c(SO3)平=0.96mol/L
答:平衡时O2的转化率为50%,SO3的物质的量浓度为0.96mol/L.
点评 本题考查化学平衡计算、平衡状态的判断、化学反应是能量变化、热化学方程式书写等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


科目:高中化学 来源: 题型:选择题
| A. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| B. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| C. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P2VP和I2的复合物是绝缘体,不能导电 | |
| B. | 电池工作时,碘离子移向P2VP和I2的复合物 | |
| C. | 电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI | |
| D. | 若该电池所产生的电压较高,则该电池使用寿命比较长 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 | |
| D. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:1 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com