
 (双烯合成,也可表示为
(双烯合成,也可表示为 )
)

| 2H2 |
| Ni |
| -2H2O |

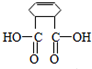 ,F与HOCH2CH2CH2CH2OH在浓硫酸作用下发生酯化进行的缩聚反应形成高分子化合物M,则M为
,F与HOCH2CH2CH2CH2OH在浓硫酸作用下发生酯化进行的缩聚反应形成高分子化合物M,则M为 ,据此解答.
,据此解答.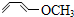 b.
b.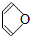 e.
e.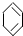 中2个C=C双键通过1个C-C单键连接,与1,3-丁二烯具有类似的性质,故答案为:abe;
中2个C=C双键通过1个C-C单键连接,与1,3-丁二烯具有类似的性质,故答案为:abe; ,F与HOCH2CH2CH2CH2OH在浓硫酸作用下发生酯化进行的缩聚反应,形成高分子化合物M,M为
,F与HOCH2CH2CH2CH2OH在浓硫酸作用下发生酯化进行的缩聚反应,形成高分子化合物M,M为 ,
, ,
, ;
; ,
, .
.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
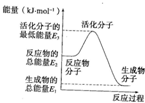 已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1
已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、H2的燃烧热为△H=-241.8kJ?mol-1 |
| C、由反应③知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为92.4kJ |
| D、反应③中加入催化剂,通过降低反应所需的活化能来增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:


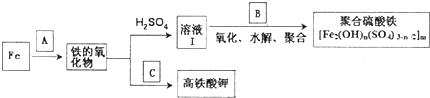
 、
、 和
和 ,它们的物质的量之比为
,它们的物质的量之比为 (用反应流程图表示并注明反应条件)
(用反应流程图表示并注明反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.
已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.| 反应 | 平衡常数(K) | 反应热(△H) | |
| 900℃ | 1100℃ | 900℃ | |
| ①Fe(s)+CO2(g) FeO(s)+CO(g) | 1.98 | 2.15 | akJ/mol |
| ②Fe(s)+H2O(g) FeO(s)+H2(g) | 1.98 | 1.47 | |
| ③CO(g)+H2O(g)CO2(g)+H2(g) | ckJ/mol | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液操作时,若要回收上层液体,应先从上口倒出上层液体,再从下口将下层液体放出 |
| B、浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 |
| C、AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 |
| D、检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B、酸碱中和滴定时用待测液润洗锥形瓶,所测结果偏高 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测最高温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种溶液pH的大小顺序:①>④>③>② |
| B、溶液①、②等体积混合后pH>7,则c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D、向溶液③、④中分别加入25mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com