
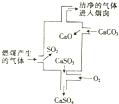
| A. | 使用此废气处理工艺不能减少SO2的排放 | |
| B. | 该过程发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用NaOH溶液检验废气处理是否达标 |
分析 A.根据废气处理工艺流程可知,该过程中减少了二氧化硫的排放;
B.碳酸钙受热生成氧化钙和二氧化碳的反应属于分解反应;二氧化硫与石灰水反应生成CaSO3和CaSO4是复分解反应和氧化还原反应;
C.反应物为碳酸钙、氧气和二氧化硫,产物为硫酸钙和二氧化碳;
D.氢氧化钠与二氧化硫的反应没有明显现象,无法检验二氧化硫.
解答 解:A.根据图示可知,使用此废气处理工艺能够大大减少SO2的排放,故A错误;
B.碳酸钙受热生成氧化钙和二氧化碳的反应属于分解反应;二氧化硫与石灰水反应生成CaSO3和CaSO4是中和反应、化合反应,氧化还原反应,但没有涉及置换反应,故B错误;
C.整个过程中,二氧化硫与碳酸钙和氧气反应生成了硫酸钙和二氧化碳,化学反应式可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2,故C正确;
D.二氧化硫具有还原性,可用酸性高锰酸钾溶液检验废气处理是否达标,而二氧化硫与氢氧化钠溶液的反应没有明显现象,无法检验二氧化硫,故D错误;
故选C.
点评 本题考查二氧化硫气体的污染和治理方法,题目难度中等,根据图示工业流程明确反应原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯能与浓硝酸、浓硫酸反应生成TNT | |
| C. | 苯酚能与FeCl3溶液发生显色反应 | |
| D. | 苯酚具有酸性,能与碳酸钠溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
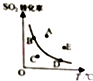 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
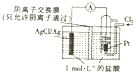
| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同,结构不同的化合物互为同分异构体 | |
| B. | 同分异构体间的相互转化不存在能量的变化 | |
| C. | C4H10的一氯代物共2种结构 | |
| D. | 甲苯( )苯环上的氢原子被一个氯原子取代后的产物共有3种 )苯环上的氢原子被一个氯原子取代后的产物共有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2H混合,充分反应后转移电子数为6NA | |
| B. | 常温下,5.6gFe与足量浓硝酸作用转移电子数一定为0.3NA | |
| C. | 65gZn与一定量的浓硫酸反应至完全溶解,转移电子数一定为2NA | |
| D. | 6.4g由S2、S4、S8组成的混合物中含有硫原子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气发生氧化反应 | |
| B. | 每转移2mol电子,电池内增加2molH2O | |
| C. | C正极附近c(H+)增大 | |
| D. | 负极附近溶液的pH值降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com