(2011?西城区一模)铬铁矿的主要成分可表示为FeO?Cr
2O
3,还含有SiO
2、Al
2O
3等杂质,以铬铁矿为原料制备重铬酸钾(K
2Cr
2O
7)的过程如下图所示.
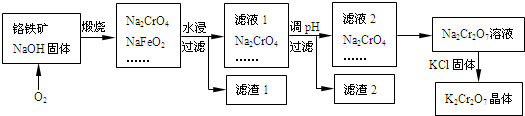
已知:①NaFeO
2遇水强烈水解.②Cr
2O
72-+H
2O

2CrO
42-+2H
+请回答:
(1)K
2Cr
2O
7中Cr元素的化合价是
+6
+6
.
(2)生成滤渣1中红褐色物质的反应的化学方程式是
NaFeO2+2H2O=NaOH+Fe(OH)3↓
NaFeO2+2H2O=NaOH+Fe(OH)3↓
.滤液1的成分除Na
2CrO
4外,还含有(填化学式)
NaAlO2、Na2SiO3和NaOH
NaAlO2、Na2SiO3和NaOH
.
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是
.
(4)由滤液2转化为Na
2Cr
2O
7溶液应采取的措施是
加硫酸酸化
加硫酸酸化
.
(5)向Na
2Cr
2O
7溶液中加入KCl固体,获得K
2Cr
2O
7晶体的操作依次是:加热浓缩、
冷却结晶
冷却结晶
、过滤、洗涤、干燥.
(6)煅烧铬铁矿生成Na
2CrO
4和NaFeO
2反应的化学方程式是
4FeO?Cr
2O
3+7O
2+20NaOH
8Na
2CrO
4+4NaFeO
2+10H
2O
4FeO?Cr
2O
3+7O
2+20NaOH
8Na
2CrO
4+4NaFeO
2+10H
2O
.


 2CrO42-+2H+
2CrO42-+2H+ 2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;
2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,故答案为:加硫酸酸化;

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案 (2011?西城区一模)向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色.X和Y可能是( )
(2011?西城区一模)向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色.X和Y可能是( )