
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液:K+、Na+、Cu2+、SO42—
B.c(OH-)=10-13mol· L-1的溶液:Al3+、NO3—、I-、Cl-
C.水电离产生的c(H+)=10-13mol·L-1的溶液:Na+、Cl-、NO3—、SO42—
D.0.1 mol·L-1 FeSO4溶液:K+、NH4+、MnO4—、ClO-
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学能与热能练习卷(解析版) 题型:选择题
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A.Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH=-0.72 kJ/mol
B.Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH=-2.92 kJ/mol
C.Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH=-16.4 kJ/mol
D.Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH=-73.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本理论练习卷(解析版) 题型:选择题
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuO B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:选择题
运用有关概念判断下列叙述正确的是( )
A.1 mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C. 和
和 互为同系物
互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是( )
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2 L气体(标准状况下) ②常温常压下,16 g O2和16 g O3含氧原子数均为NA ③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA ④6.5 g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1NA ⑤10.6 g Na2CO3粉末中含有CO32—数为0.1NA
A.②④⑤ B.①③⑤ C.①②④⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。

编号 | 反应物 | 反应前pH | 反应前pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2 (g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )

A.该反应的焓变和熵变:ΔH>0,ΔS<0
B.温度降低,该反应的平衡常数K增大
C.升高温度,n(CH3OH)/n(CO2)增大
D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 元素及其化合物练习卷(解析版) 题型:填空题
合金是建造航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置为________。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为________。
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________________________。
焊接过程中使用的保护气为________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为________。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为________。
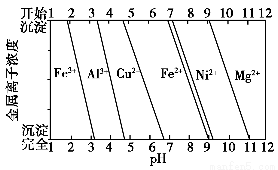
(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0 g,则合金中Cu的质量分数为________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合题图信息推断该合金中除铜外一定含有________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第8讲电化学练习卷(解析版) 题型:选择题
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )。

A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料为铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com