
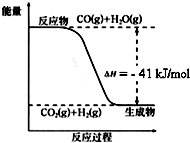
 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.分析 (1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从图上可见反应放热,降温平衡正向移动,K增大;
(3)据K=9和开始时CO和水蒸气的起始浓度都是0.1mol/L,计算平衡时浓度计算;
(4)利用盖斯定律,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
解答 解:(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大,故答案为:增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以K=$\frac{[C{O}_{2}]•[{H}_{2}]}{[CO]•[{H}_{2}O]}$;从图上可见反应放热,降温平衡正向移动,K增大,
故答案为:$\frac{[C{O}_{2}]•[{H}_{2}]}{[CO]•[{H}_{2}O]}$;>;
(3)K=9和开始时CO和水蒸气的起始浓度都是0.1mol/L,设平衡时H2O的转化浓度为x,则有$\frac{{x}^{2}}{(0.1-x)^{2}}$=9,x=$\frac{0.3}{4}$=0.075mol/L,v(H2O)=$\frac{0.075mol/L}{10min}$=0.0075 mol/(L•min);正反应放热,所以体系的能量将减少;1mol水蒸气反应放热41KJ,0.075mol/L×2L=0.15mol水蒸气反应放热6.15KJ,
故答案为:0.0075 mol/(L•min);减少;6.15;
(4)已知:①CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41KJ/mol
②2H2(g)+O2(g)?2H2O(g)△H=-484kJ/mol
据盖斯定律①×2+②得:2CO(g)+O2(g)?2CO2(g)△H=-566KJ/mol,
故答案为:2CO(g)+O2(g)?2CO2(g)△H=-566KJ/mol.
点评 本题考查平衡移动对反应物转化率的影响,以及化学平衡常数的求算和盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | D>C>B>A | B. | A>B>C>D | C. | B>A>C>D | D. | A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | NaOH溶液 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H6(C2H4) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg原子结构示意图  | B. | NaCl的电子式  | ||
| C. | CO2分子的结构式O-C-O | D. | 乙烯的结构简式CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cl-、OH- | B. | Fe2+、H+、NO3-、SO42- | ||
| C. | NH4+、K+、HCO3-、OH- | D. | Fe3+、NH4+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ;F与NaOH溶液共热发生反应的化学方程式为:
;F与NaOH溶液共热发生反应的化学方程式为: .
. (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 | |
| D. | 元素的第一电离能:Al<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com