
| A. | 1.0×10-3摩尔 | B. | 1.6×10-3摩尔 | C. | 2.2×10-3摩尔 | D. | 2.7×10-3摩尔 |
分析 铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
解答 解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,
则n(NO2)+n(NO)=$\frac{33.6×1{0}^{-3}L}{22.4L/mol}$=1.5×10-3mol,
即被还原的硝酸的物质的量为1.5×10-3mol,
n(Cu)=$\frac{38.4×1{0}^{-3}}{64}$=0.6×10-3mol,则生成n[Cu(NO3)2]=0.6×10-3mol,
可知表现酸性的硝酸的物质的量为0.6×10-3mol×2=1.2×10-3mol,
则:参加反应的硝酸的物质的量为:1.2×10-3mol+1.5×10-3mol=2.7×10-3mol,
故选D.
点评 本题考查化学方程式的计算,但该题可不同书写有关反应的方程式,注意浓硝酸和稀硝酸的性质的不同,从质量守恒的角度解答该题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
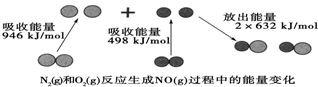 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 夏季气温高,PAN含量高 | |
| B. | 气压低,化学平衡常数增大,PAN含量高 | |
| C. | 减少氮氧化物的排放可以减少PAN的含量 | |
| D. | 大气中灰尘可起催化作用,能提高过氧乙酰基的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
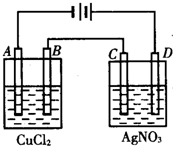 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | PAFC因水解而能净水 | |
| B. | 往甲溶液中滴入KSCN溶液后呈血红色 | |
| C. | 试剂X具有氧化性 | |
| D. | 乙溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com