
【题目】下列变化过程不可逆的有( )
A.蛋白质的变性B.乙酸的电离C.蛋白质的盐析D.酯的水解
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:
共价键 | C-C | C=C | C-H | H-H |
键能/(kJ/mol) | 348 | 610 | 413 | 436 |
依据上述数据,求得①~④的△H:
①![]() (g)+3H2(g)→
(g)+3H2(g)→ (g) △H=-384kJ/mol
(g) △H=-384kJ/mol
②C2H2(g)+H2(g)→CH2=CH2(g) △H=-128kJ/mol
③CH2=CH-CH=CH2(g)+H2(g)→CH3-CH2-CH=CH2(g) △H=-128kJ/mol
④ (g)→
(g)→ (g)+H2(g) △H=128kJ/mol
(g)+H2(g) △H=128kJ/mol
下列判断正确的是( )
A. ①②③④均正确 B. ②③④正确 C. ③④正确 D. ④正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用98%浓硫酸(密度1.84g/cm3)配制浓度为0.5mol/L稀硫酸480 mL。
(1) 选用的主要仪器有:量筒、烧杯、玻璃棒、___________、___________。
(2) 应量取浓硫酸的体积为__________mL,现有①10mL②20mL③50mL三种规格的量筒,则所需选用的量筒是___________(填代号)。
(3) 配制时,一般可分为以下几个步骤: ①量取 ②计算 ③稀释 ④摇匀(上下颠倒) ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序是______________________________。
(4) 在配制过程中,其他操作都准确,下列操作能引起所配溶液浓度偏低的有_____.
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②定容时,加蒸馏水超过标线,又用胶头滴管吸出
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑥定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
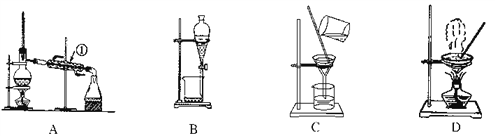
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.10 mol/L的硫酸920mL,某同学欲用密度为1.84 g/cm![]() 、溶质的质量分数为98%的浓硫酸进行稀释配制。试回答:
、溶质的质量分数为98%的浓硫酸进行稀释配制。试回答:
(1)需选用_______容量瓶(填序号)
A. 50mL B. 100 mL C. 250 mL D. 1000 mL
(2)98%浓硫酸的浓度为_______mol/L (提示:用浓度和密度的换算公式计算) ,需量取浓硫酸______ml。
(3)若提供如下仪器:A. 量筒 B. 托盘天平 C. 玻璃棒 D. 容量瓶 E. 胶头滴管 F. 烧杯
完成该实验需选用仪器_______________(将仪器标号填在横线上)。
(4)下列操作会使所配制的溶液物质的量浓度一定偏低的是___________。
A. 容量瓶底部有蒸馏水 B. 向容量瓶转移溶液时,有少量液体溅出 C. 加水时,水量超过了刻度线
(5)下列关于容量瓶的使用方法中,正确的是__________________(填序号)。
A. 使用前要检验是否漏水 B. 在容量瓶中直接溶解固体或稀释液体
C. 溶液未经冷却即注入容量瓶中 D. 向容量瓶中转移溶液可以不用玻璃棒引流
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com