
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
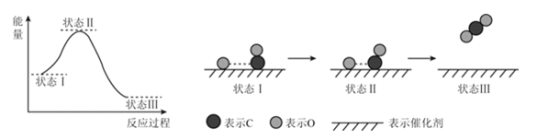
下列说法中正确的是
A. CO和O生成CO2是吸热反应 B. 在该过程中,CO断键形成C和O
C. CO和O生成了CO2 D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
科目:高中化学 来源: 题型:
【题目】在2A+B=3C+4D反应中,表示该反应速率最快的数据是
A. v(A)=0.5mol·L-1·s-1 B. v(B)=3mol·L-1·min-1
C. v(C)=0.9mol·L-1·s-1 D. v(D)=1.0mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2 +2H2O ,
Cl2↑+MnCl2 +2H2O ,
(1)反应物HCl中氯元素的化合价____,HCl在反应中表现的性质包括_______和______。
(2)在该氧化还原反应中,MnO2 做_________剂,锰元素被________。
(3)写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式___________________________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是_______离子交换膜(填“阳”或“阴”)。阴极区的电极反应式为_____________。
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生____mol气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境,提倡“低碳生活”,是我们都应关注的社会问题。
(1)目前,一些汽车已改用天然气(CNG)做燃料,以减少对空气污染。
①16g甲烷完全燃烧生成液态水放出890kJ热量,则甲烷燃烧的热化学方程式是__________。
②1mol碳完全燃烧生成二氧化碳气体放出393.5kJ热量,通过计算比较,填写下列表格(精确到0.01):
物质质量1g | 燃烧放出的热量/kJ | 生成CO2的质量/g |
碳 | 32.80 | ____________ |
甲烷 | ____________ | 2.75 |
根据表格中的数据,天然气与煤相比,用天然气做燃料的优点是__________。
(2)为了减少二氧化碳的排放,利用海藻可将二氧化碳、氢气转化成水及一种可以再生的绿色能源乙醇,该反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的![]() 在
在![]() 中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.05molNaClO。氢气和氯气物质的量之比是( )
中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.05molNaClO。氢气和氯气物质的量之比是( )
A.2:3B.3:1C.1:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应
B. 用溴水可以区分苯乙烯和乙苯
C. 1 mol苯乙烯最多可与4 mol氢气加成,加成产物的一氯代物共有5种
D. 乙苯和苯乙烯分子中共平面的碳原子数最多都为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com