
| A. | A的平均反应速率为 0.1 mol/(L•min) | |
| B. | 平衡时,C的浓度为 0.125 mol/L | |
| C. | 平衡时,B的转化率为 20% | |
| D. | 平衡时,容器内压强为原来的 0.8 倍 |
分析 5min后反应达到平衡,容器内压强变小,则有x+2<3+1,x<2,只能为x=1,D的平均反应速率为0.1mol/(L•min),生成n(D)=2L×5min×0.1mol/(L•min)=1mol,则:
3A(g)+B(g)  C(g)+2D(g)
C(g)+2D(g)
起始(mol):3 2.5 0 0
转化(mol):1.5 0.5 0.5 1
平衡(mol):1.5 2 0.5 1
A.根据v=$\frac{△c}{△t}$计算v(A);
B.根据c=$\frac{n}{V}$计算C的平衡浓度;
C.B的转化率=$\frac{反应的B的物质的量}{B的起始物质的量}$×100%;
D.恒温恒容下,压强之比等于物质的量之比.
解答 解:5min后反应达到平衡,容器内压强变小,则有x+2<3+1,x<2,只能为x=1,D的平均反应速率为0.1mol/(L•min),生成n(D)=2L×5min×0.1mol/(L•min)=1mol,则:
3A(g)+B(g)  C(g)+2D(g)
C(g)+2D(g)
起始(mol):3 2.5 0 0
转化(mol):1.5 0.5 0.5 1
平衡(mol):1.5 2 0.5 1
A.v(A)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L•min),故A错误;
B.平衡时C的浓度为$\frac{0.5mol}{2L}$=0.25mol/L,故B错误;
C.B的转化率=$\frac{0.5mol}{2.5mol}$×100%=20%,故C正确;
D.恒温恒容下,压强之比等于物质的量之比,平衡时,容器内压强为原来的$\frac{5}{5.5}$=$\frac{10}{11}$ 倍,故D错误,
故选:C.
点评 本题考查化学平衡的计算,难度不大,关键是确定x的值,注意掌握三段式法在化学平衡计算中应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl属于共价化合物,溶于水能电离出H+和Cl- | |
| B. | NaOH是离子化合物,该物质中只含离子键 | |
| C. | HI气体受热分解的过程中,只需克服分子间作用力 | |
| D. | 石英和干冰均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
 (X代表卤素原子);
(X代表卤素原子);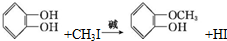 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离饱和食盐水与沙子的混合物 | |
| B. | 分离水和汽油的混合物 | |
| C. | 分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物. | |
| D. | 从硝酸钾和氯化钠的混合液中获得硝酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com