
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。

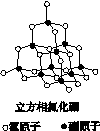
(1)基态硼原子的电子排布式为________。
(2)关于这两种晶体的说法,正确的是________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B—N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是_____________________________________________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根椐这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4 含有________mol配位键。
(1)1s22s22p1 (2)b、c (3)平面三角形 层状结构中没有自由移动的电子 (4)sp3 高温、高压 (5)2
[解析] (1)硼原子的核外电子数是5,则基态硼原子的电子排布式为 1s22s22p1。(3)根据题目和图示的信息可知:六方相氮化硼与石墨相似,都为混合型晶体,立方相氮化硼与金刚石相似,都为原子晶体,且硼原子和氮原子都形成σ键。则a、d选项错误。(3)基态硼原子外围电子排布式为2s22p1,层内一个硼原子与相邻的三个氮原子形成3个σ键,无孤对电子,其构成的空间构型为平面三角形。六方相氮化硼与石墨相似,但不能导电说明没有自由移动的电子。(4)中心原子的杂化轨道数n=成键数+孤对电子对数,根据图示可知,立方相氮化硼中硼原子与周围4个氮原子形成4个σ键,且硼原子不存在孤对电子,则n=4,硼原子的杂化轨道类型为sp3杂化。根据该天然矿物在青藏高原地下约300 km的古地壳中被发现,可推断该条件为高温高压;或者根据石墨转化成金刚石所需要的条件是高温高压,则六方相氮化硼合成立方相氮化硼的条件也是高温高压。(5)NH4BF4中存在NH 和BF
和BF ,1个NH
,1个NH 中存在一个配位键,1个BF
中存在一个配位键,1个BF 中存在1个配位键,则1 mol NH4BF4中存在2 mol配位键。
中存在1个配位键,则1 mol NH4BF4中存在2 mol配位键。


科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
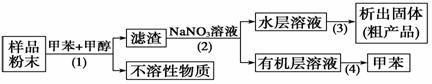
下列说法错误的是 ( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
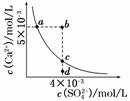 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
( )
A.在任何溶液中,c(Ca2+)、c(SO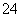 )均相等
)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO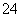 )一定等于3×10-3 mol/L
)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物中,含有非极性共价键的离子化合物是( )
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3
Ⅱ.[2013·海南卷] (14分)
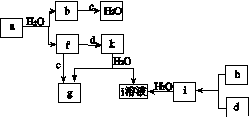
图(a)所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图(b)所示。
(a)

(b)
回答下列问题:
(1)图(b)对应的物质名称是________,其晶胞中的原子数为________,晶体的类型为________。
(2)d中元素的原子核外电子排布式为____________。
(3)图(a)中由二种元素组成的物质中,沸点最高的是________,原因是____________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图(a)中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
请回答下列问题:
(1)31Ga基态原子的核外电子排布式是________________。某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是________,其晶体结构类型可能为________。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
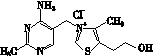
以下关于维生素B1的说法正确的是________。
A.只含σ键和π键
B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl
D.该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________。
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是重要的金属,广泛应用于电气、机械制造和国防等领域。铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)Cu原子的价层电子排布式为________。
(2)CuSO4晶体中S原子的杂化方式为________,SO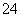 的立体构型为________。
的立体构型为________。
(3)向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4。下列说法正确的是( )
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成了3种不同的氢键
b.NH3分子和H2O分子的分子空间构型不同,氨气分子的键角小于水分子的键角
c.[Cu(NH3)4]SO4所含有的化学键有离子键、极性共价键和配位键
d.[Cu(NH3)4]SO4的组成元素中,电负性最大的是氮元素
(4)葡萄糖与新制Cu(OH)2的碱性溶液反应生成红色Cu2O沉淀。在1个Cu2O晶胞中(结构如图K334所示),所包含的Cu原子的数目为________;每个氧原子与________________________________________________________________________
个铜原子配位。

图K334
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.工业上用电解熔融氯化钠的方法制取钠
B.钠加入氯化镁的饱和溶液中可以制取金属镁
C.电解冶炼铝的原料是氯化铝
D.电解氯化镁溶液来制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
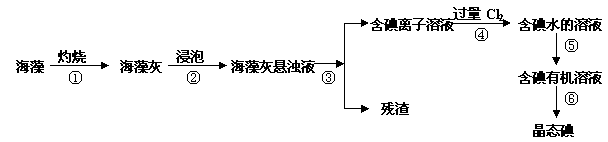
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2 (s)+Mn2O3(s),下列说法错误的是( )
(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极反应为2MnO2(s)+H2O(l)+2e-―→Mn2O3(s)+2OH-(aq)
C.电池工作时,负极附近溶液碱性增强
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com