
【题目】乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJg-1,则△H3=___kJmol-1
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___,![]() =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
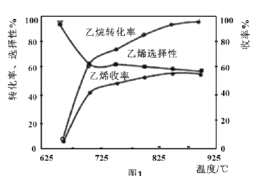
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
【答案】< -2615.8 B 0.025 molL1min1 0.75 温度升高,反应速率加快,转化率升高 C 正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动
【解析】
⑴反应III是体积减小的反应。
⑵先根据乙烯的热值为50.4kJ·g1,求出△H2,再根据盖斯定律计算△H3。
⑶①该反应是放热反应,降低温度,速率降低;②建立三步走进行计算。
⑷①由图可知,随温度的升高,乙烷的转化率再升高,考虑化学反应速率的影响因素;根据图中要使乙烷的转化率尽可能高,而副产物又相对较少,及乙烯的选择性较高。
②正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,利于平衡正向移动。
⑴反应III是体积减小的反应,因此△S < 0;故答案为:<。
⑵已知乙烯的热值为50.4kJ·g1,则△H2=-1411.2 kJ·mol1将第II个方程式的2倍减去第I个方程式得到III,则△H3=-2615.8·mol1;故答案为:-2615.8·mol1。
⑶①该反应是放热反应,反应达到平衡后,仅降低温度,速率降低,k正、k逆匀减小,平衡向放热方向即正向进行,正反应速率大于逆反应速率,因此k正减小的倍数更少;故答案为:B。
②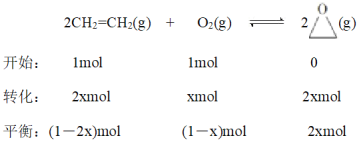
![]() ,x=0.25mol,则0~10min内
,x=0.25mol,则0~10min内![]() ,k逆c2(
,k逆c2(![]() )=k正c2(CH2=CH2)c(O2),
)=k正c2(CH2=CH2)c(O2),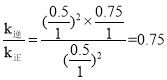 ;故答案为:0.025 molL1min1;0.75。
;故答案为:0.025 molL1min1;0.75。
⑷①由图可知,随温度的升高,乙烷的转化率再升高,考虑化学反应速率的影响因素,温度升高,反应速率加快,转化率升高;根据图中要使乙烷的转化率尽可能高,而副产物又相对较少,及乙烯的选择性较高,应找到乙烯收率较高时的温度,对应温度为850℃;故答案为:温度升高,反应速率加快,转化率升高;850℃。
②工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动;故答案为:正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动。


科目:高中化学 来源: 题型:
【题目】镁能在二氧化碳中燃烧:2Mg+CO2![]() 2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
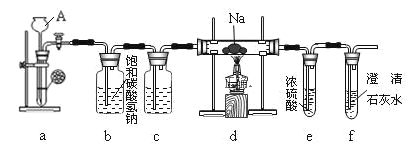
请回答下列问题:
(1)装置a中发生的是实验室制CO2的反应,反应方程式为___。
(2)装置b中发生反应的离子方程式为___,装置c的作用为___。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是___。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸, 溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
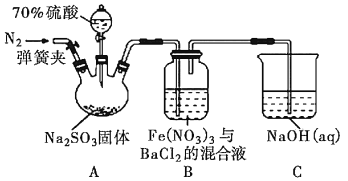
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO![]()
B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.65g锌加入50mL 1mol/L 的稀盐酸中,计算:
(1)标准状况下,生成H2的体积_________;
(2)反应后溶液中Zn2+和H+的物质的量浓度(假设反应后,溶液体积仍为50mL)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 ℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述不正确的是( )
A. 此时水的离子积Kw=1.0×10-12
B. 溶液中水电离出的c(H+)=1.0×10-10mol·L-1
C. 水的电离度随温度升高而增大
D. c(H+)<c(SO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
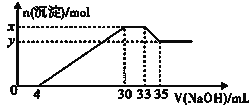
A.x-y=0.01molB.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/LD.原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
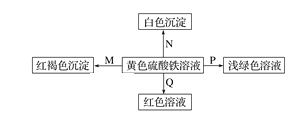
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )
2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )

A.反应物的总能量低于生成物的总能量
B.断开1molH—H键和1molI—I键所需能量大于断开2 molH—I键所需能量
C.断开2mol H—I键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量等于2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL5mol/L稀硝酸中加入19.2g铜粉,待充分反应,判断下列说法正确的是(忽略反应前后溶液体积的变化)( )
A.反应中转移电子的物质的量为0.6NA
B.标准状况下,产生NO2气体的体积为4.48L
C.反应后,H+的物质的量浓度为1.0mol/L
D.被还原的HNO3的物质的量为0.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com