
| 19.2g |
| 64g/mol |
| 19.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、Na2O2 Al2(SO4)3 MgCl2 K2CO3 |
| B、BaCl2 Na2SO4 (NH4)SO4 KOH |
| C、AgNO3 NaCl KCl CuCl2 |
| D、Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH试纸用蒸馏水湿润后测某溶液的pH |
| B、在中和热的测定实验中用Ba(OH)2代替NaOH;H2SO4代替HCl |
| C、用碱石灰来干燥氨气 |
| D、使用托盘天平称量时将药品放在天平的右盘与砝码放在天平的左盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
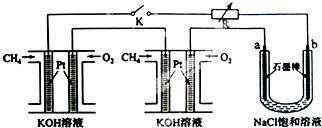
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com