
| A. | 标准状况下,密度为dg/L的某气体纯净物一个分子的质量为22.4d/NAg | |
| B. | 加热条件下,20mL10mol/L的浓硝酸与足量铜反应转移电子数为0.1NA | |
| C. | 电解精炼铜的过程中转移了NA个电子,则阴极析出32g铜 | |
| D. | 1L pH=1的硫酸溶液中,含有0.1NA个H+ |
分析 A、标准状况下,密度为dg/L的某气体纯净物摩尔质量=22.4dg/mol;
B、浓硝酸随着反应进行浓度减小为稀硝酸时与铜反应转移电子增多;
C、电解精炼铜时,阴极是铜离子放电,若转移了NA个电子,有0.5mol铜单质生成;
D、pH=1说明氢离子的浓度为c(H+)=0.1mol/L;
解答 解:A、标准状况下,密度为dg/L的某气体纯净物摩尔质量=22.4dg/mol;一个分子的质量为22.4d/NAg,故A正确;
B、20mL10 mol/L 浓硝酸物质的量为0.2mol,和铜反应,浓度减小为稀硝酸,和铜反应时转移电子数增多,剩余转移电子数应大于0.1NA,故B错误;
C、电解精炼铜时,阴极是铜离子放电,若转移了NA个电子,有0.5mol铜单质生成,质量为0.5mol×64g/mol=32g,故C正确;
D、pH=1说明氢离子的浓度为c(H+)=0.1mol/L,所以n(H+)=0.1mol/L×1L=0.1mol,即为0.1NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素B的单质与化合物A2D反应能生成D的单质 | |
| B. | 工业上利用铝热反应可制得单质C | |
| C. | 原子B、C、D半径的大小顺序:D>C>B | |
| D. | 一定条件下,过量的B单质与D单质直接生成BD3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
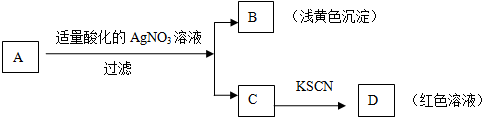
| A. | 盐A一定是FeBr3 | B. | 浅黄色沉淀B是AgBr | ||
| C. | 滤液C中一定含Fe 3+ | D. | D溶液中有Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
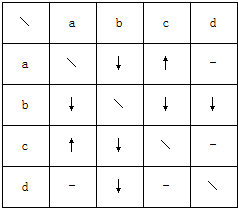
| A. | a可能是NaHCO3溶液 | B. | b一定是Ba(OH)2溶液 | ||
| C. | c一定是稀硫酸 | D. | d一定是MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2W-+Z2═W2+2Z- | B. | 2Y-+W2═Y2+2W- | C. | 2Z-+X2═Z2+2X- | D. | 2X-+Y2═X2+2Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2既是氧化剂,又是还原剂 | |
| B. | 还原产物与氧化产物的物质的量之比为5:1 | |
| C. | 当转移了3 mol电子时,反应消耗了3 mol的Cl2 | |
| D. | 反应中NaOH提供了碱性环境,但它既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
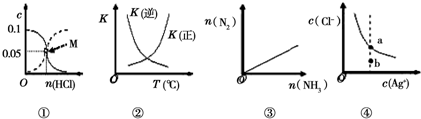
| A. | 图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化.实现表示c(NH3•H2O),虚线表示c(NH4+),处于M点时溶液呈中性 | |
| B. | 图②表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. | 图③表示2NH3(g)?N2(g)+3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 | |
| D. | 图④表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
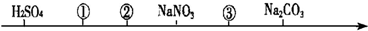
| A. | CH3COOH HCl CH3COONa | B. | HCl CH3COOH NaHCO3 | ||
| C. | NH4Cl CH3COOH NaOH | D. | NH4Cl HCl CH3COONa |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com