
【题目】(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
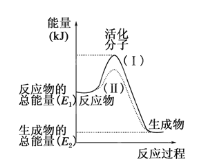
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将___ ___转化为___ _____。
(3)50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
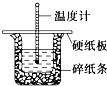
①从实验装置上看,图中尚缺少的一种玻璃用品是 .
②烧杯间填满碎纸条的作用是 .
③大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”).
④实验中改用60mL 0.50molL﹣1盐酸跟50 mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”或“无影响”)
【答案】(12分)
(1)放热(2)放出,11,化学能,热能
(3)①环形玻璃搅拌棒,②隔热,③偏小,
④不相等,相等,因为中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关.
⑤偏小.
【解析】
试题分析:(1)因为反应物的总能量大于生成物的总能量,所以反应为放热。
(2)1摩尔氢气和1摩尔碘反应生成碘化氢的反应热为436+151-299*2=-11KJ,所以反应放出了11KJ的热量,在化学反应过程中是将化学能转化为热能。
(3)①中和热实验测定中,需要环形玻璃搅拌棒。②烧杯间填满碎纸条的作用是隔热。③如果不盖硬纸板,会有热量损失,实验数值偏小。④因为反应的酸和碱的物质的量改变,所以放出的热量不相等,但因为中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关,所以所求的中和热相等。⑤因为氨水有电离平衡,电离吸热,所以实验测得的中和热的数值会偏小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备氯化铵、纯碱、金属镁等物质,其流程如下图所示:
 (1)反应①~⑤中,属于氧化还原反应的是__________(填编号)
(1)反应①~⑤中,属于氧化还原反应的是__________(填编号)
(2)写出反应②的离子方程式_______________
(3)X溶液中的主要阳离子是Na+和___________
(4)已知氨气极易溶于水,实验室可用NH4Cl和Ca(OH)2固体混合加热制取。根据流程原理制取碳酸氢钠固体,下列实验装置正确且能达到实验目的的是_________

A.用装置甲制取氨气
B.用装置乙制取二氧化碳
C.用装置丙制取碳酸氢钠
D.用装置丁分离碳酸氢钠固体与母液
(5)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次滴加过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③______________;④滴加适量盐酸;⑤_____________________(请补全缺少的实验操作)
(6)检验纯碱样品中是否含NaCl,至少应选用的试剂是____________________
(7)电解熔融氯化镁制镁,得到的镁蒸气可在下列哪种气体氛围中冷却(填序号)________________
A.H2 B.CO2 C.O2 D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是( )
A. KMnO4 B. HNO3 C. Cl2水 D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列关于0.2 mol·L-1 Ba(NO3)2溶液的说法不正确的是 ( )。
A.2 L溶液中阴、阳离子总数为0.8NA
B.500 mL溶液中NO3-浓度为0.4 mol·L-1
C.500 mL溶液中Ba2+浓度为0.2 mol·L-1
D.500 mL溶液中NO3-总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
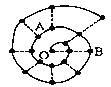
A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最终能生成含三价铁的化合物的是
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③过量的Fe在Cl2中燃烧
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:A B C D 。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E形成的化合物 ;D、E形成的化合物 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com