
| A. | 金属铁 | B. | 干冰 | C. | 酒精 | D. | 硫酸钡 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物,物质的水溶液能导电,说明其溶于水后能其本身或生成的物质能电离出自由移动的离子,据此分析.
解答 解:A、金属铁是单质,既不是电解质也不是非电解质,故A错误;
B、干冰即固态的二氧化碳,溶于水后生成碳酸,能电离出自由移动的离子而导电,故二氧化碳的水溶液能导电;但由于二氧化碳溶于水后不是其本身电离出自由移动离子而导电,其在熔融状态下又不导电,故二氧化碳本身为非电解质,故B正确;
C、酒精的水溶液不导电,故C错误;
D、硫酸钡在熔融状态下能导电,故为电解质,故D错误.
故选B.
点评 本题考查电解质和溶液导电的原因,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、K、Cl2 | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
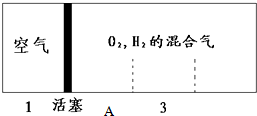 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH2 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol.L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g.L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)^{3}}$ | |
| D. | 2ρ1=ρ2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com