
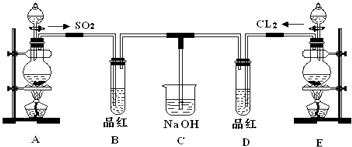
分析 A用于制备SO2,可用Na2SO3与硫酸反应制取,B用于检验二氧化硫的生成,E用浓盐酸和二氧化锰在加热条件下制备氯气,D用于检验气体的漂白性,C用于吸收尾气.
解答 解:(1)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,该反应为Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,用MnO2和浓盐酸在加热的条件下制备氯气,
故答案为:硫酸;MnO2;
(2)①次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,两者都能使品红褪色,
故答案为:品红溶液褪色;品红溶液褪色;
②次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的.加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时会变成红色,
故答案为:溶液由无色变成红色;溶液没有明显变化;
(3)二氧化硫、氯气都可与氢氧化钠反应且能污染空气,用氢氧化钠可吸收尾气,防止污染空气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,碱性条件下生成硫酸钠和氯化钠,反应的离子方程式为SO2+Cl2+4OH-=SO42-+2Cl-+2H2O,故答案为:吸收尾气;Cl2+2OH-=Cl-+ClO-+H2O;SO2+Cl2+4OH-=SO42-+2Cl-+2H2O.
(4)SO2和Cl2按1:1通入发生SO2+Cl2+4OH-=SO42-+2Cl-+2H2O,如氯气的量大于SO2,氯气与氢氧化钠反应生成氯化钠、次氯酸钠,溶液中还存在ClO-,
如SO2过量,氯气完全反应生成Cl-,
故答案为:ClO-;Cl-.
点评 本题考查物质的性质实验,侧重于学生的分析、实验能力的考查,题目涉及二氧化硫与氯气的制取以及二氧化硫漂白与次氯酸漂白的区别,题目难度中等,注意尾气的处理方法.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 含氢原子的物质之间均可形成氢键 | |
| D. | 分子间形成的氢键使物质的熔点和沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |
| A.验证甲烷与氯气发生化学反应 | B.实验室制取乙酸乙酯 |
 |  |
| C.提取含杂质的粗苯甲酸 | D.提纯含杂质的工业酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
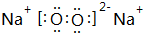 ,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com