
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的原子结构示意图为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,用离子方程式解释原因: 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
(1) (2分); (2)N2H4的电子式
(2分); (2)N2H4的电子式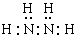 (2分)
(2分)
(3)NH4+ + H2O  NH3·H2O + H+(2分)
NH3·H2O + H+(2分)
(4)NH4++HSO3-+2OH-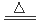 NH3+H2O+SO32-(2分)
NH3+H2O+SO32-(2分)
(5)HN3(2分); 2.24L(2分)
【解析】
试题分析:由于X是原子半径最小的元素,所以X是H元素,加入Z的原子序数是m,则Y是(m-1);W是(m+8)。1+(m-1)+m+(m+8)=32。解得m=8。所以Y是N,Z是O;W是S。(1)Z原子的原子结构示意图为 ,(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲是N2H4。则甲的电子式是:
,(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,则甲是N2H4。则甲的电子式是: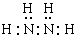 ;(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,该盐是(NH4)2SO4,该盐是强酸弱碱盐,NH4+发生水解反应消耗水电离产生的OH-,破坏了水的电离平衡,促进水的电离,最终当达到平衡时c(H+)>c(OH-),使溶液显酸性,用离子方程式表示为:NH4+ + H2O
;(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,该盐是(NH4)2SO4,该盐是强酸弱碱盐,NH4+发生水解反应消耗水电离产生的OH-,破坏了水的电离平衡,促进水的电离,最终当达到平衡时c(H+)>c(OH-),使溶液显酸性,用离子方程式表示为:NH4+ + H2O  NH3·H2O + H+;(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。该盐是酸式盐,有还原性,应该是NH4HSO3.加热条件下乙与过量NaOH溶液反应的离子方程式是NH4++HSO3-+2OH-
NH3·H2O + H+;(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。该盐是酸式盐,有还原性,应该是NH4HSO3.加热条件下乙与过量NaOH溶液反应的离子方程式是NH4++HSO3-+2OH- NH3+H2O+SO32-。(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,则每个分子中含有N:(43×97.7%)÷14=3,含有H:43—3×14=1,所以该氢化物的分子式为HN3;该氢化物受撞击时完全分解为氮气和氢气,2HN3
NH3+H2O+SO32-。(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,则每个分子中含有N:(43×97.7%)÷14=3,含有H:43—3×14=1,所以该氢化物的分子式为HN3;该氢化物受撞击时完全分解为氮气和氢气,2HN3  H2↑+3N2↑.n(HN3)=2.15g÷43g/mol=0.05mol,所以根据方程式可知该氢化物受撞击后产生的气体在标况下的体积为(0.05mol÷2) ×4×22.4mol/L=2.24L。
H2↑+3N2↑.n(HN3)=2.15g÷43g/mol=0.05mol,所以根据方程式可知该氢化物受撞击后产生的气体在标况下的体积为(0.05mol÷2) ×4×22.4mol/L=2.24L。
考点:考查元素及化合物的推断、原子结构示意图的书写、物质的电子式、化学式的确定、盐的水解、离子方程式的书写及有关氧化还原反应的计算的知识。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:选择题
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格是
A.1000mL B.950mL C.任意规格 D.500mL
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷(解析版) 题型:选择题
有Mg、Al、Fe、Cu四种金属,若两两混合,取混合物26 g与足量稀硫酸反应产生标准状况下氢气11.2 L,则此混合物的可能组合最多有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一12月月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.铝与氢氧化钠溶液反应 :2Al +2 OH-=2AlO2-+3H2O
B.将磁性氧化铁溶于盐酸:
C.用氢氧化钠溶液除去铝表面的氧化膜: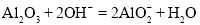
D.过氧化钠溶于盐酸:Na2O2+2H+=2Na++2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一12月月考化学试卷(解析版) 题型:选择题
下列各组反应中最终肯定有白色沉淀的是
A.向饱和碳酸钠溶液中通入过量CO2
B.氯化亚铁溶液中加入少量过氧化钠
C.AlCl3溶液中加入过量氢氧化钠溶液
D.氯化钙溶液中通入过量CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | K1=1.77×10-4 | K1=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
B.相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者
C.2CN-+H2O+CO2 = 2HCN+CO32-
D.2HCOOH+CO32-= 2HCOO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
C.正反应进行的程度大,正反应速率一定大
D.化学平衡发生移动时,化学反应速率一定变化
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:实验题
(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图中Ⅰ~Ⅳ所示。
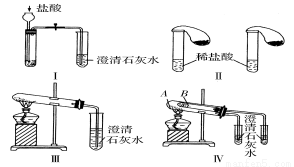
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)____ ____。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________________。
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)___ ____;
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管A中装入的固体最好是(填化学式)___ _____。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为_________________________;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为______,请设计实验检验所得溶液中溶质的阴离子___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.通入少量HCl气体,溶液中PH值增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com