

| 物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 水中 溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
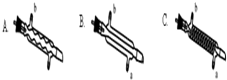
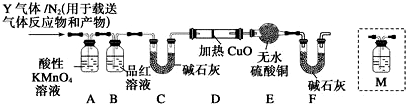
分析 (1)在三颈瓶中氢气和四氯化碳可以充分混合;
(2)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿;
(3)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢;
(4)蒸馏装置中通常选用直形冷凝管,便于液体流下;冷却水采用逆流的方式冷却效果较好;
(5)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可书写化学方程式;
(7)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)三颈瓶中,氢气和四氯化碳蒸汽可以充分混合,有利于制备氯仿,
故答案为:A装置的作用是使氢气和四氯化碳蒸汽充分混合;
(2)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿,
故答案为:加热时氢气遇氧气发生爆炸(或生成的氯仿被氧气氧化);
(3)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢,反应方程式为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl,
故答案为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl;
(4)蒸馏装置中通常选用直形冷凝管,便于液体流下,故选B;冷却水采用逆流的方式冷却效果较好,所以冷水应从该冷凝管的a口接入,
故答案为:B;a;
(5)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤,用以洗掉NaHCO3和NaCl,
故答案为:洗掉NaHCO3和NaCl;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可知化学方程式为2CHCl3+O2=2COCl2+2HCl,
故答案为:2CHCl3+O2=2COCl2+2HCl;
(7)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{15g}{24.6g}$×100%≈61%,
故答案为:61%.
点评 本题考查了物质制备方案的设计,题目难度中等,涉及仪器的使用、化学实验基本操作方法、化学计算等知识,明确实验目的为解答关键,试题知识点较多、综合性较强,充分考查了学生的化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 次氯酸 | 干冰 |
| B | 冰 | 氨水 | 碳酸钙 | 氢氟酸 | 氨气 |
| C | 氯水 | 漂白粉 | 苛性钾 | 氢硫酸 | 氯化银 |
| D | 胆矾 | 福尔马林 | 氯化钡 | 碳酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl互为同位素 | |
| D. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl是两种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体,生成Cu(NO3)2 | |
| C. | 与Na2CO3反应放出CO2气体,生成NaNO3 | |
| D. | 与S单质混合共热时生成H2SO4和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验 编号 | 温度 /℃ | 平衡常数 /mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=2.4 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v(SO2)=0.2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
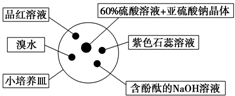 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaCl溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀HCl溶液中滴加稀HNO3 | D. | 向NaOH溶液中滴加Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com