
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+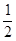 O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac
+ CO + NH3  [Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为 。
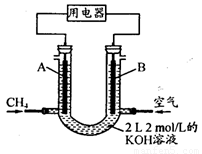
② 44.8 L<V≤89.6 L时,负极电极反应为 。
③ V=67.2 L时,溶液中离子浓度大小关系为 。
(1)CH4 (g)+CO2 (g) =2CO (g)+2H2 (g) △H=+247.4 kJ·mol-1(2)反应②是放热反应,可节省能源;同时制得的CO与H2物质的量之比为1:2,能恰好反应合成甲醇,符合绿色化学的“原子经济”原则。(3)低温、高压(4) ①CH4 + 2O2 + 2KOH =K2CO3 + 3H2O ②CH4—8e-+ 9CO32-+3H2O =10HCO3-③c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
试题分析:(1)根据盖斯定律可知,①×2-③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),所以其△H=[(+206.2)×2-(+165.0)]kJ•mol-1=+247.4 kJ•mol-1,所以CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ•mol-1 (2)从能量角度比较,①是吸热反应,需要消耗更多能量,②是放热反应,不需要太多能量;从原子利用率角度,由于CO+2H2→CH3OH,①的产物中氢原子不可能全部变为CH3OH,而②的产物中所有原子都可能全部变为CH3OH;因此选②,甲烷不完全燃烧制合成气时放出热量,还得到物质的量之比为1:2的CO和H2的混合气体,能恰好完全反应生成甲醇(3)已知正反应是气态物质体积减小的放热反应,因此采用降低温度、增大压强能使平衡右移,提高CO的转化率,故答案为:低温、高压(4)(4)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,故答案为:CH4+2O2+2KOH=K2CO3+3H2O;②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故答案为:CH4-8e-+9CO32-+3H2O=10 HCO3-;③当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
考点:用盖斯定律进行有关反应热的计算;化学电源新型电池


科目:高中化学 来源: 题型:013
下列说法中不正确的是
[ ]
A.海水中溶解有多种化学元素,常被称为“液体矿山”
B.海底蕴藏着大量的锰结核矿,它是浅褐色至黑色的结核状矿物体
C.波浪能、潮汐能和海流能均属于海洋能源,可作新能源开发作用
D.从海水中可以提取人类生活所必需的任何用品
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列有关“可燃冰”的叙述中不正确的是( )
A.“可燃冰”也可能成为人类未来的重要能源
B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”为水可能变成油提供了有利的证据
D.“可燃冰”的主要可燃成分是甲烷
(2)“可燃冰”的平均组成可用下列的化学式表示( )
A.3CH4·H2O B.CH4·3H2O C.CH4·6H2O D.CH4·8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
第28届国际地质大会提供的资料显示,海底蕴藏着大量的天然气水合物,俗称“可燃冰”,1体积“可燃冰”可贮藏100—200体积的天然气。“可燃冰”是一种晶体,晶体中平均每46个H2O分子构建成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充,请根据上述信息完成下面试题。
13.下列有关“可燃冰”的叙述中不正确的是( )
A.“可燃冰”也可能成为人类未来的重要能源
B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”为水可能变成油提供了有利的证据
D.“可燃冰”的主要可燃成分是甲烷
14.“可燃冰”的平均组成可用下列的化学式表示( )
A.3CH4·H2O B.CH4·3H2O C.CH4·6H2O D.CH4·8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
第28届国际地质大会提供的资料显示,海底蕴藏着大量的天然气水合物,俗称“可燃冰”,1体积“可燃冰”可贮藏100~200体积的天然气。“可燃冰”是一种晶体,晶体中平均每46个H2O分子构建成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充,“可燃冰”的平均组成可用下列的化学式表示
A.3CH4?H2O B.CH4?3H2O C.CH4?6H2O D.CH4?8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com