
| A. | 青蒿素属于烃 | B. | 青蒿素属于烷烃 | ||
| C. | 青蒿素属于无机化合物 | D. | 青蒿素属于有机化合物 |
科目:高中化学 来源: 题型:实验题
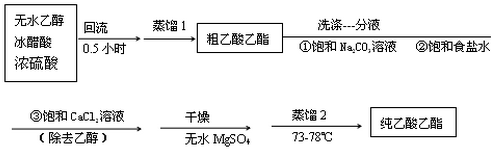
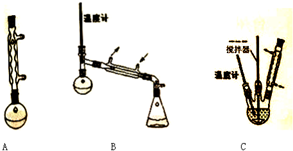
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第1次 | 0.00 | 1.98 |
| 第2次 | 1.98 | 4.00 |
| 第3次 | 4.00 | 5.80 |
| 第4次 | 5.80 | 7.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙烷和新戊烷 | |
| B. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| C. | 对氯甲苯和邻氯乙苯 | |
| D. | 甲基丙烯酸和甲酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 升高温度正反应速率增大,则逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 ,氯元素的原子结构示意图
,氯元素的原子结构示意图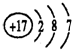 ;
; ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 | |
| B. | 取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n | |
| C. | 取等体积的两种酸溶液分别与足量的锌粒反应,生成氢气的体积醋酸大于盐酸 | |
| D. | 取等体积的两种酸溶液分别与NaOH溶液中和,消耗NaOH的物质的量醋酸大于盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com