
 .
. +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$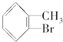 +HBr或
+HBr或 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$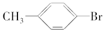 +HBr.
+HBr. 分析 (1)乙醇能够与氧化铜加热条件下能够反应生成乙醛和水;
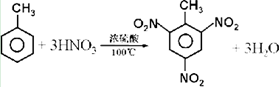
(2)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水;
(3)乙酸乙酯和氢氧化钠反应生成乙醇和醋酸钠;
(4)卤代烃在碱的醇溶液中加热发生消去反应生成烯烃;
(5)乙炔和氢气在催化剂下发生加成反应生成乙烯;
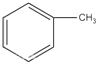
(6)甲苯与液溴在铁粉作用下反应,苯环上的氢与溴发生取代反应,主要取代甲基邻位、对位的氢原子,也可能取代间位上的氢原子.
解答 解:(1)加热条件下,氧化铜能够将乙醇氧化成乙醛,反应的化学方程式为:CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O,
故答案为:CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O;
(2)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水发生的是取代反应,反应的化学方程式为: ,
,
故答案为: ;
;
(3)乙酸乙酯在碱性条件下的水解方程式是:CH3COOC2H5+NaOH→CH3COONa+C2H5OH,
故答案为:CH3COOC2H5+NaOH→CH3COONa+C2H5OH;
(4)2-氯丙烷与KOH的乙醇溶液供热发生消去反应,方程式为CH3-CHCl-CH3+NaOH$→_{△}^{乙醇}$CH3-CH=CH2+NaCl+H2O,
故答案为:CH3-CHCl-CH3+NaOH$→_{△}^{乙醇}$CH3-CH=CH2+NaCl+H2O;
(5)乙炔和氢气在催化剂下发生加成反应生成乙烯,反应的方程式为CH≡CH+H2$→_{△}^{催化剂}$CH2=CH2,
故答案为:CH≡CH+H2$→_{△}^{催化剂}$CH2=CH2;
(6)甲苯与液溴混合,加入铁粉作催化剂,只能取代苯环上的氢原子,同时甲基对苯环的影响,主要取代甲基邻位、对位的氢原子,也可能取代间位上的氢原子,所以主要反应为: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,或
+HBr,或 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,
+HBr,
故答案为: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr或
+HBr或 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.
点评 本题考查了有机反应方程式的书写,题目难度中等,注意掌握常见有机反应方程式的书写方法,明确反应原理为解答本题的关键,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
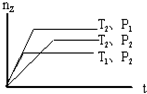 反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,△H<0 | B. | T1<T2,P1>P2,△H>0 | ||
| C. | T1>T2,P1>P2,△H<0 | D. | T1>T2,P1<P2,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用铜丝或铁丝代替铂丝 | |
| B. | 用固体样品或配成的溶液进行实验,现象相同 | |
| C. | 每次实验前,铂丝要先用硫酸洗涤 | |
| D. | 焰色反应实验所用火焰,无论何种燃料均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C5H12 | C. | C8H18 | D. | C9H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
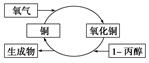
| A. | 1丙醇发生了还原反应 | |
| B. | 生成物可以发生银镜反应 | |
| C. | 反应中有红黑颜色交替变化的现象 | |
| D. | 2丙醇也能发生图示的催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
下列设计的实验方案能达到实验目的是
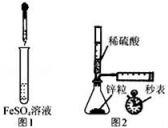
A.制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B.测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C.除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D.检验淀粉是否水【解析】
取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com