
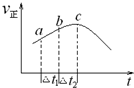
 ��1��NO2��SO2��Ͽɷ�����Ӧ��SO2��g��+NO2��g���TSO3��g��+NO��g�����ٽ�һ������NO2��SO2���ھ��Ⱥ����ܱ������з���������Ӧ������Ӧ������ʱ��仯��������ͼ��ʾ����ͼ��֪����˵����ȷ����C������ĸ����
��1��NO2��SO2��Ͽɷ�����Ӧ��SO2��g��+NO2��g���TSO3��g��+NO��g�����ٽ�һ������NO2��SO2���ھ��Ⱥ����ܱ������з���������Ӧ������Ӧ������ʱ��仯��������ͼ��ʾ����ͼ��֪����˵����ȷ����C������ĸ�������� ��1��A����Ӧ�ڴﵽƽ��״̬ʱ����Ӧ����Ӧ���ֲ��䣻
B�����ŷ�Ӧ�Ľ��У���Ӧ��Ũ��Խ��ԽС��
C������ͼ��֪���÷�Ӧ�ھ��������½��У���Ӧ�������¶Ⱥ�Ũ�ȵ�����Ӱ�죬��Ӧ������������С��˵���÷�ӦΪ���ȷ�Ӧ���������¶����߷�Ӧ��������Ũ���½�����Ӧ�����½������Է�Ӧ����������������������������
D������ͼ��֪��ab�ε�����С��bc�Σ����ԡ�t1=��t2ʱ��SO2����������a��b��С��b��c�Σ�
��2����a����������ļ�������ȣ�������ϵ��ѹǿʼ�ղ������仯��
b��V��CO��=V��H2O����δ��ӳ������Ĺ�ϵ��
c����������ļ�������ȣ���������ƽ��Ħ������һֱ���䣻
d��1mol H-H�����ѵ�Ч������2mol H-O����ͬʱ����2mol H-O����
�����������ټ���һ������N2��ʹ������ѹǿ��������ֵ�Ũ�Ȳ��䣬��Ӧ���ʲ��䣬�����������¶���Ӧ���ʼ�С��
��CO��g��+H2O��g���TCO2��g��+H2��g��
�������ʵ�����1mol 2mol
�仯���ʵ�����0.6mol 0.6mol 0.6mol 0.6mol
ƽ��ʱ��������0.4mol 1.4mol 0.6mol 0.6mol
����v=$\frac{��c}{��t}$=$\frac{\frac{0.6mol}{2L}}{4min}$=0.075mol•L-1•min-1��CO2���������Ϊ $\frac{0.6}{1+2}$��100%=20%��
��� �⣺��1��A����Ӧ�ڴﵽƽ��״̬ʱ����Ӧ����Ӧ���ֲ��䣬��A����
B�����ŷ�Ӧ�Ľ��У���Ӧ��Ũ��Խ��ԽС�����Է�Ӧ��Ũ�ȣ�a�����b�㣬��B����
C������ͼ��֪���÷�Ӧ�ھ��������½��У���Ӧ�������¶Ⱥ�Ũ�ȵ�����Ӱ�죬��Ӧ������������С��˵���÷�ӦΪ���ȷ�Ӧ���������¶����߷�Ӧ��������Ũ���½�����Ӧ�����½������Է�Ӧ������������������������������C��ȷ��
D������ͼ��֪��ab�ε�����С��bc�Σ����ԡ�t1=��t2ʱ��SO2����������a��b��С��b��c�Σ���D����
��ѡC��
��2����a����������ļ�������ȣ�������ϵ��ѹǿʼ�ղ������仯�����Բ�һ��ƽ�⣬�ʴ���
b��V��CO��=V��H2O����δ��ӳ������Ĺ�ϵ���ʴ���
c����������ļ�������ȣ���������ƽ��Ħ������һֱ���䣬���Բ�һ��ƽ�⣬�ʴ���
d��1mol H-H�����ѵ�Ч������2mol H-O����ͬʱ����2mol H-O�������淴Ӧ������ȣ�����ȷ��
��ѡ��d��
�����������ټ���һ������N2��ʹ������ѹǿ��������ֵ�Ũ�Ȳ��䣬��Ӧ���ʲ��䣬�����������¶���Ӧ���ʼ�С���ʴ�Ϊ�����䣻��С��
��CO��g��+H2O��g���TCO2��g��+H2��g��
�������ʵ�����1mol 2mol
�仯���ʵ�����0.6mol 0.6mol 0.6mol 0.6mol
ƽ��ʱ��������0.4mol 1.4mol 0.6mol 0.6mol
����v=$\frac{��c}{��t}$=$\frac{\frac{0.6mol}{2L}}{4min}$=0.075mol•L-1•min-1��CO2���������Ϊ $\frac{0.6}{1+2}$��100%=20%���ʴ�Ϊ��0.075mol•L-1•min-1��20%��
���� ���⿼�黯ѧƽ��֪ʶ�����ݱȽ��ۺϣ���������˸߿����ۺ��ԣ������ۺ��Խ�ǿ�����⣬ֻҪϸϸ�����������ܸ���ͻ�Ƶģ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��п��ϡ���ᷴӦʱ����������CuSO4��Һ��Ӧ���ʼӿ� | |
| B�� | ������Ͱ�ĶƲ���������ܿ������ƶ� | |
| C�� | �ִ���ˮ�����µĴ�����װ��һ��������п�� | |
| D�� | ��Ƭ�������ⷽ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
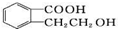 ���л������ͨ����ͬ�ķ�Ӧ�õ�������������
���л������ͨ����ͬ�ķ�Ӧ�õ�������������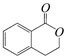 ����
����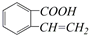 ��
��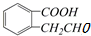 ��
�� ��
��| A�� | ȡ����Ӧ����ȥ��Ӧ��������Ӧ���ӳɷ�Ӧ | |
| B�� | ȡ����Ӧ����ȥ��Ӧ��������Ӧ��ȡ����Ӧ | |
| C�� | ������Ӧ��ȡ����Ӧ�����۷�Ӧ��ȡ����Ӧ | |
| D�� | ������Ӧ����ȥ��Ӧ��ȡ����Ӧ��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��O2��=0.02mol•L-1•min-1 | B�� | v��SO3��=0.04mol•L-1•min-1 | ||
| C�� | v��SO2��=0.02mol•L-1•min-1 | D�� | v��SO3��=0.01mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �٢ڢܢ� | C�� | �٢ܢ� | D�� | �٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | VA�T0.5mol L-1S-1 | B�� | VB�T0.3mol L-1S-1 | ||
| C�� | VC�T4.8mol L-1min-1 | D�� | VD�T1mol L-1S-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��58.5 g NaCl����1 Lˮ�пɵ�1 mol•L-1��NaCl��Һ | |
| B�� | ��1 L 1 mol/L��NaCl��Һ��ȡ��10 mL����Ũ������1 mol/L | |
| C�� | �к�100 mL 1 mol/L��H2SO4��Һ�������Σ���NaOH 4 g | |
| D�� | ��78 g Na2O2����ˮ�����1 L��Һ�ɵõ�Ũ��Ϊ1 mol•L-1��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
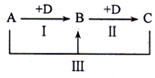 A��B��C��D��ʾ��ѧ��ѧ�е����ֳ������ʣ�����A��B��C������ͬһ��Ԫ�أ���һ���������ת����ϵ��ͼ�����ַ�Ӧ�е�ˮ����ȥ����
A��B��C��D��ʾ��ѧ��ѧ�е����ֳ������ʣ�����A��B��C������ͬһ��Ԫ�أ���һ���������ת����ϵ��ͼ�����ַ�Ӧ�е�ˮ����ȥ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com