
在KC1、MgCl2、Mg(NO3)2形成的混合溶液屮,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L, c(Cl-) = 0.2mol/L,则c(NO3-)为
A.0.05 mol/L B.0.20mol/L C.0.30 mol/L D.0.40 mol/L
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考文化学卷(解析版) 题型:填空题
在2L固定容积的密闭容器中,在不同反应时间各物质的物质的量的变化情况如图所示。
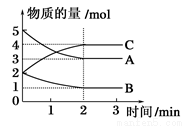
(1)该反应的化学方程式是__________________;
(2)0~2 min,C的平均反应速率为___________;
(3)2 min后,A、B、C各物质的量不再随时间的变化而变化,说明在此条件下,反应已达到了___________状态。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式:H2B=H++HB-,HB- H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1) NaHB溶液显 (填“酸性”“中性”或“碱性”)。理由是 。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)0.1 mol·L-1 Na2B溶液中各种离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1, 满足此条件的溶液中一定可以大量共存的离子组是( )
满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NH4+、Cl- B.K+、Na+、Cl-、AlO2-
C. K+、Na+、Cl-、NO3- D.K+、CO32-、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上期中化学卷(解析版) 题型:选择题
下列离了方程式,正确的是
A.氢氧化铁与盐酸反应:H++OH-=H2O
B.少量CO2通入澄清石灰水使其变浑浊:CO2+Ca2++2OH-=CaCO3↓+H2O
C.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.液态HC1不能导电,所以HC1是非电解质
B.酸性氧化物一定是非金属氧化物
C.在水溶液中能电离产生H的化合物不定是酸
D.盐、碱一定含有金属元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:填空题
工业上用CO生产燃料甲醇。一定条件下发生反应:
CO(g)+2 H2(g)  CH3OH(g)
CH3OH(g)
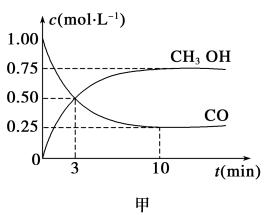
(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_____________;
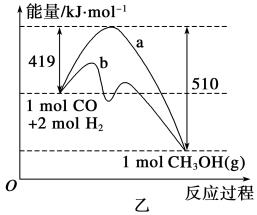
(2)乙图表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应的焓变是________(填“ΔH<0”或“ΔH>0”)反应,写出反应的热化学方程式:______ _;选择适宜的催化剂__________(填“能”或“不能”)改变该反应的反应热。
(3)恒容条件下,下列措施中能使 增大的有____________。
增大的有____________。
a.升高温度 b.充入1mol He气
c.再充入1 mol CO和2 mol H2 d.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:选择题
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,其过程表示为:CuSO4·5H2O(s) = Cu2+(aq)+SO42-(aq)+5 H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s) =Cu2+(aq)+SO42-(aq) 热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) 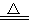 CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
A.△H1<△H3 B.△H2>△H3
C.△H1+△H3 =△H2 D.△H1+△H2 >△H3
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上期中化学试卷(解析版) 题型:填空题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4?(绿色)、Cr2O72?(橙红色)、CrO42?(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是______________。
(2)CrO42?和Cr2O72?在溶液中可相互转化。室温下,初始浓度为1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42?的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42?的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl?,利用Ag+与CrO42?生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为______________ mol·L?1,此时溶液中c(CrO42?)等于_______________ mol·L?1。(已知Ag2 CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72?还原成Cr3+,反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com