
| A. | 46g乙醇中含有共价键的数目为7NA | |
| B. | 50ml 2mol•L-1NaClO溶液中ClO-数目为0.1NA | |
| C. | 标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NA | |
| D. | 常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA |
分析 A、求出乙醇的物质的量,然后根据乙醇中含8条共价键来分析;
B、次氯酸跟为弱酸根,在溶液中会水解;
C、在标况下,铁在浓硫酸中会钝化;
D、CO2和N2O的摩尔质量均为44g/mol,且均为三原子分子.
解答 解:A、46g乙醇的物质的量为n=$\frac{46g}{46g/mol}$=1mol,而乙醇中含8条共价键,故1mol乙醇中含8mol共价键即8NA个,故A错误;
B、次氯酸跟为弱酸根,在溶液中会水解,故溶液中的次氯酸根的个数小于0.1NA个,故B错误;
C、在标况下,铁在浓硫酸中会钝化,故不能反应完全,则转移的电子数小于0.2NA个,故C错误;
D、CO2和N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,且两者均为三原子分子,故0.1mol混合物中含0.3mol原子即0.3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| B. | 金属钠着火时不能使用泡沫灭火器灭火 | |
| C. | 因为NH4Cl受热易分解,实验室应保存在棕色试剂瓶中 | |
| D. | 铁粉作食品袋内的脱氧剂,起还原作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
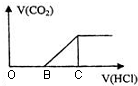 向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2→HCO3- | |
| C. | 若溶液M中c(NaHCO3)=2c(Na2CO3),则3OB=BC | |
| D. | 若溶液M中大量存在的阴离子为CO32-和HCO3-,则OB>BC |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、CO2 都是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物相同 | |
| C. | SO2、NO、CO2都是大气污染物,在空气中都能稳定存在 | |
| D. | HCl、HNO3都是强酸,和FeO的反应都属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度实验次数 | 起始温度t2 /℃ | 终止温度 t2 /℃ | 温度差平均值 (t2- t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
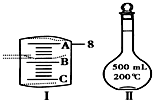 实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题:
实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属制成合金,可以保持甚至强化单一金属的长处,克服其不足 | |
| B. | 在自然环境中,锡青铜中的锡对铜起保护作用 | |
| C. | 锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生成Cu2(OH)3Cl覆盖物是化学反应过程,但不是电化学腐蚀过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com