
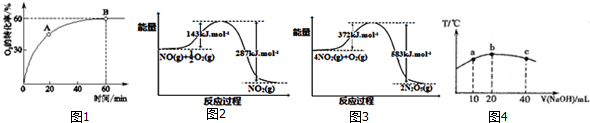
 ����ͼ��ش����ߢ�NOת�������¶����߶������ԭ��Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ����ͼ2�л�����Ӧ2NO��g��+2CO��g��?N2��g��+2CO2��g���ڲ�ͬ�¶��´ﵽƽ��ʱc��N2���ı仯����ͼ��
����ͼ��ش����ߢ�NOת�������¶����߶������ԭ��Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ����ͼ2�л�����Ӧ2NO��g��+2CO��g��?N2��g��+2CO2��g���ڲ�ͬ�¶��´ﵽƽ��ʱc��N2���ı仯����ͼ������ ��1�����ݡ�SCl2�백��ȫ��Ӧ����A�͵���ɫ����B�����ӻ�����X����X��ˮ��Һ��pH��7��A����������ǿ�ȿɵõ� B�����嵥��C��֪B��S��A��N��SԪ�أ�C�ǵ�����X���Ȼ�泥�n��A��=$\frac{18.4g}{184g/mol}$=0.1mol��n��S��=$\frac{12.8g}{32g/mol}$=0.4mol����A�к�N��$\frac{��18.4-0.4��32��g}{14g/mol}$=0.4mol����A�ķ���ʽΪS4N4������ԭ���غ����д����Ӧ����ʽ��
��2�����ݷ�Ӧ�Է����е������ǡ�H-T��S��0�����жϣ�
��3����N2��g��+O2��g��=2NO��g����H=+180.5kJ•mol-1
��2C��s��+O2��g��=2CO��g����H=-221.0kJ•mol-1
��C��s��+O2��g��=CO2��g����H=-393.5kJ•mol-1
���ݸ�˹���ɢۡ�2-��-�ڼ��㣻
��4������2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-746.5kJ•mol-1���������¶ȣ�ƽ�����淴Ӧ�����ƶ�������NO��ת����Ӧ�ü�С�������ߢ�NOת�������¶����߶�����˵����Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ�ݴ˷�����
��5������HNO2?H++NO2-��ϵ��볣��K=4.6��10-4���㣮
��� �⣺��1����Ϊ��SCl2�백��ȫ��Ӧ����A�͵���ɫ����B�����ӻ�����X����X��ˮ��Һ��pH��7��A����������ǿ�ȿɵõ� B�����嵥��C��֪B��S��A��N��SԪ�أ�C�ǵ�����X���Ȼ�泥�n��A��=$\frac{18.4g}{184g/mol}$=0.1mol��n��S��=$\frac{12.8g}{32g/mol}$=0.4mol����A�к�N��$\frac{��18.4-0.4��32��g}{14g/mol}$=0.4mol����A�ķ���ʽΪS4N4������SCl2�백��Ӧ����A�͵���ɫ����B�����ӻ�����X����Ӧ����ʽ��6SCl2+16NH3=S4N4+2S+12NH4Cl��
�ʴ�Ϊ��6SCl2+16NH3=S4N4+2S+12NH4Cl��
��2����ΪC����ȫȼ��ʱ����COΪ���ȷ�Ӧ����2CO��g��=2C��s��+O2��g����H��0�����ر��С�ķ�Ӧ����H��0����S��0�����H-T��S��0����Ӧ�κ��¶��¶������Է����У��ʴ�Ϊ�������У���Ϊ��H��0����S��0�����κ�����¶������Է����У�
��3����N2��g��+O2��g��=2NO��g����H=+180.5kJ•mol-1
��2C��s��+O2��g��=2CO��g����H=-221.0kJ•mol-1
��C��s��+O2��g��=CO2��g����H=-393.5kJ•mol-1
���ݸ�˹���ɢۡ�2-��-�ڵ�2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-393.5��2-180.5+221.0=-746.5kJ•mol-1���ʴ�Ϊ��-746.5kJ•mol-1��
��4�����ݣ�3��2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-746.5kJ•mol-1���������¶ȣ�ƽ�����淴Ӧ�����ƶ�������NO��ת����Ӧ�ü�С�������ߢ�NOת�������¶����߶�����˵����Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ��
��2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-746.5kJ•mol-1���������¶ȣ�ƽ�����淴Ӧ�����ƶ��������¶�Խ�ߣ�ƽ��ʱc��N2��ԽС����仯����ͼΪ ���ʴ�Ϊ����Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ��
���ʴ�Ϊ����Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ�� ��
��
��5����ΪHNO2�ĵ��뷽��ʽΪHNO2?H++NO2-���ֵ��볣��K=4.6��10-4������K=$\frac{c��H{\;}^{+}��c��NO{\;}_{2}{\;}^{-}��}{c��HNO{\;}_{2}��}$=$\frac{c{\;}^{2}��H{\;}^{+}��}{0.01mol/L}$=4.6��10-4����ã�c��H+��=2.14��10-3mol•L-1���ʴ�Ϊ��2.14��10-3��
���� ���⿼���Ϊ�ۺϣ��漰��ѧ����ʽ��д����˹����Ӧ�á�Ӱ��ƽ���ƶ��������Լ�ƽ�ⳣ���ļ����֪ʶ���Ǹ߿����ȵ����ͣ�����ʱ���ø�˹������Ӧ��ע�ⷽ��ʽ����ʱ����H�ķ��ź���ֵ��ע��Ӱ�컯ѧƽ������ظ�Ƶ���㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| Al��OH��3 | Fe��OH��2 | Fe��OH��3 | Mg��OH��2 | |
| ��ʼ����ʱ | 3.8 | 5.8 | 2.2 | 10.6 |
| ��ȫ����ʱ | 4.7 | 8.3 | 4.0 | 12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
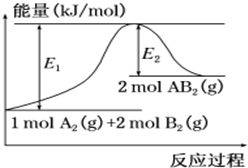 ��֪ij��ѧ��ӦA2 ��g��+2B2 ��g���T2AB2��g�� ��AB2�ķ��ӽṹΪB-A-B���������仯��ͼ��ʾ�������й���������ȷ���ǣ�������
��֪ij��ѧ��ӦA2 ��g��+2B2 ��g���T2AB2��g�� ��AB2�ķ��ӽṹΪB-A-B���������仯��ͼ��ʾ�������й���������ȷ���ǣ�������| A�� | �÷�Ӧ�Ľ���һ����Ҫ���� | |
| B�� | �÷�Ӧ�ġ�H=-��E1-E2��kJ/mol | |
| C�� | �÷�Ӧ�з�Ӧ��ļ����ܺʹ���������ļ����ܺ� | |
| D�� | ����1��mol��A-A��2��mol��B-B�ų�E1��kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��CO��g��+H2S��g��?COS��g��+H2��g���ﵽƽ��������¶ȣ�H2SŨ�����ӣ������÷�Ӧ�����ȷ�Ӧ | |
| B�� | ��CO��g��+H2S��g��?COS��g��+H2��g���ﵽƽ���ͨ��CO������Ӧ���������� | |
| C�� | һ�������·�ӦN2+3H2?2NH3�ﵽƽ��ʱ��3v����H2��=2v�棨NH3�� | |
| D�� | ���ڷ�ӦCO��g��+H2O��g��?CO2��g��+H2��g����H��0��ֻ�ı�ѹǿ��ƽ�ⲻ�����ƶ�����Ӧ�ų����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����y mol H2ֻ��1 mol MHx | |
| B�� | ƽ��ʱ����������ѹǿ��С | |
| C�� | �����£��÷�Ӧ��ƽ�ⳣ������ | |
| D�� | ����������ͨ��������������v�����⣩��v�����⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������FeCl3��Һ�μ�����ˮ��ֱ�Ӿ����Ƶ�Fe��OH��3���� | |
| B�� | ����������������ɢϵ�ı��������ǽ������ӵ�ֱ����С | |
| C�� | �ù��˵ķ������Է�����ᴿ���� | |
| D�� | ���Ĺ����з����˽���ĵ�Ӿ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com