
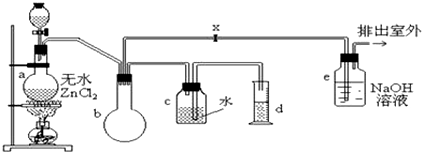
分析 (1)根据制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸可知制备一氯甲烷的原理,据此写出反应的化学方程式;
(2)由于氯化氢极易挥发,而氯化氢又极易溶解在水中,所以装置b的作用是防止倒吸,保证安全;
(3)卤代烃能发生碱性水解,转化为醇,由于在生成醇的同时,还生成氯化氢,则最终e中发生的反应有:一氯甲烷与氢氧化钠溶液反应、氯化氢与氢氧化钠溶液反应;
(4)根据一氯甲烷的组成元素可知,一氯甲烷燃烧的生成物应该是CO2、水和氯化氢;
(5)实际按甲醇和浓盐酸1:2(物质量之比)进行反应,显然盐酸是过量的,目的应该是增加一种反应物(浓盐酸)的量,提高另一反应物(甲醇)的转化率;
(6)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出,使实际产量少.
解答 解:从左向右的实验仪器作用分别为:制取一氯甲烷,防倒吸,排水法收集一氯甲烷气体,接收排水集气体时排出的水,尾气吸收;
(1)制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸,故该实验中的一氯甲烷应该用甲醇和浓盐酸制得,反应的化学方程式为:CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O,该反应为取代反应,
故答案为:CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O;取代;
(2)由于氯化氢极易挥发,而氯化氢又极易溶解在水中,所以装置b的作用是防止倒吸,保证安全,
故答案为:防止倒吸,保证安全;
(3)浓盐酸易挥发,卤代烃能发生水解,生成乙醇和氯化氢,装置e为尾气吸收装置,吸收的为氯化氢气体,发生的反应为:NaOH+HCl=NaCl+H2O;一氯甲烷还能够与氢氧化钠酸溶液反应生成甲醇和氯化钠,反应的化学方程式为:CH3Cl+NaOH $\stackrel{H_{2}O}{→}$CH3OH+NaCl,
故答案为:CH3Cl+NaOH $\stackrel{H_{2}O}{→}$CH3OH+NaCl;NaOH+HCl=NaCl+H2O;
(4)根据一氯甲烷的组成元素可知,一氯甲烷燃烧的生成物应该是CO2、水和氯化氢,则CH3Cl燃烧的化学方程式是:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl,
故答案为:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl;
(5)根据CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O知:甲醇和浓盐酸1:1(物质量之比)反应恰好反应,而实际按甲醇和浓盐酸1:2(物质量之比)进行反应,显然盐酸是过量的,目的应该是增加一种反应物(浓盐酸)的量,提高另一反应物(甲醇)的转化率,使甲醇充分反应,转化成一氯甲烷;
故答案为:可使甲醇充分反应,转化成一氯甲烷;
(6)根据已知条件可知,甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出,所以收集到一定体积的气体产物所消耗的甲醇、浓盐酸的混和溶液的量比正常情况下多;
故答案为:甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出.
点评 本题考查物质制备的有关实验设计、操作、评价以及有关反应式的书写等知识点,题目难度中等,明确实验目的、实验原理为解答关键,试题综合性强,侧重对学生实验能力的培养.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | v (X)正=v (X)逆=0 | |
| B. | v (X):v (Y)=l:2 | |
| C. | 容器内X、Y、Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1 molX同时生成0.2molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NH4Cl溶液蒸干制备NH4Cl固体 | |
| B. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 | |
| C. | 用重结晶法除去KNO3中混有的NaCl | |
| D. | 将混有少量氯化氢气体的Cl2通入NaOH溶液中除去氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素组成的化合物CA为共价化合物 | |
| B. | B元素可形成多种同素异形体 | |
| C. | C元素存在多种核素 | |
| D. | D的氧化物是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
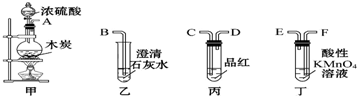
| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com