
【题目】甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为( )
A.5.4 gB.3.6 gC.2.7 gD.1.8 g
【答案】A
【解析】
根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,反应结束后测得生成的气体体积比为甲:乙=1:2,由化学反应方程式可知,酸与金属反应时酸不过量,碱与金属反应时碱过量来计算解答。
根据方程式,当铝分别和盐酸、氢氧化钠反应时,若消耗等量的铝,生成的气体体积比为1:1。若铝过量,等量的盐酸和氢氧化钠,生成的气体体积比为2:1。所以当两烧杯中生成的气体体积比为1:2时,可推知两烧杯中,生成的气体少的甲烧杯中铝有剩余,生成气体多的乙烧杯中铝不足。因为等量的铝消耗的盐酸物质的量更大,故甲烧杯中装盐酸;乙烧杯中装氢氧化钠。盐酸和氢氧化钠溶液中溶质的物质的量均为![]() ,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则
,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则
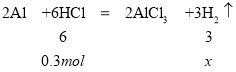
解得x=0.15mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为![]() ,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则
,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则
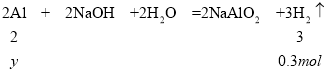
解得y=0.2mol,则铝的质量为![]() 。
。
故答案选:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,回答下列问题:
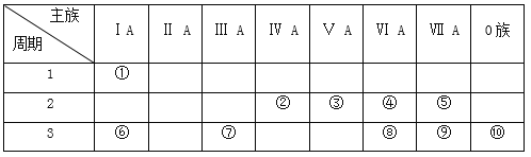
(1)上述元素最高价氧化物对应水化物中,酸性最强的是__________(填化学式),碱性最强的是__________(填化学式),显两性的是__________(填名称)。
(2)气态氢化物中,最稳定的是__________(填化学式),④⑧形成的氢化物中沸点最高的是__________(填化学式),原因是__________________。
(3)④分别和①、⑥两种元素的原子按1:1组成的常见化合物的电子式分别为__________和_______。用电子式表示②和④的三原子分子的形成过程____________。
(4)④⑥⑦⑨的简单离子半径由大到小的顺序为__________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式___________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g)![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2
A.①②③④B.①②④⑥C.①②③⑥D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法不正确的是( )
出发合成BHT的方法有如下两种。下列说法不正确的是( )
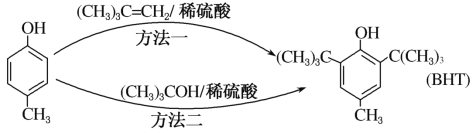
A. 方法一和方法二的反应类型都是加成反应
B. BHT与![]() 都能使酸性KMnO4溶液褪色
都能使酸性KMnO4溶液褪色
C. 推测BHT在水中的溶解度小于苯酚
D. BHT与![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-=ClO-+Cl-+H2O
B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=[Al(OH)4]-+H2↑
C.室温下用稀HNO3溶解铜:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g) +B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/0C | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.1 | 1.0 | 0.5 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H_____0(填“<” “>”或 “=”);
(2)830℃时,向体积为10L的密闭容器中充入0.2mol的A和0.2mol的B,如反应初始到10s内A的平均反应速率v(A)=0.001 mol·L-1·s-1,则10s时c(D)=_____。此时,该反应是否处于平衡状态:___(填“是”或“否”)。达到平衡时A的转化率为__________,如果这时向该密闭容器中充入1mol氦气,A的转化率__________(填“变大”、“变小”或“不变”)。
(3)可用于判断该反应达到平衡状态的依据为________(填选项符号):
a、压强不随时间改变 b、气体的密度不再发生改变
c、c(D)不随时间改变 d、单位时间内生成A和C的物质的量相等
(4)1000℃时反应C(g)+D(g) ![]() A(g) +B(g)的平衡常数的值为___________。
A(g) +B(g)的平衡常数的值为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。

①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S诱抗素Y。下列说法正确的是

A. X结构中有2个手性碳原子
B. X可以发生氧化、取代、酯化、加聚、缩聚反应
C. Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D. 1 mol X与足量NaOH溶液反应,最多消耗4 mol NaOH,1 mol Y最多能加成4 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
![]()
A. 若D是一种强碱,则A、B、C均可与X反应生成D
B. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com