
常温下,将pH=10的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述中不正确的是( )
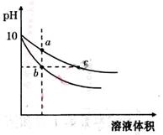
A.a、b两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+)+c(CH3COOH)=c(OH-)
D.若向上述两种溶液中分别加入相同浓度的盐酸至pH=7,则消耗盐酸体积相同
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是( )

A.甲为C,X是O2 B.甲为SO2,X是NaOH溶液
C.甲为Cl2,X为Fe D.甲为Al,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:选择题
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的焰色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z的核电荷数是W的2倍,Y是地壳中含量最多的金属元素。下列说法不正确的是
A. 工业上常用电解的方法制备X、Y的单质
B. 元素Q和Z能形成QZ2型的共价化合物
C. 原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Q)
D. 元素X、Y、Z的最高价氧化物对应的水化物之间能相互发生反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:填空题
2016年10月17日我国神舟十一号载人飞船在酒泉卫星发射中心成功发射,为我们更好地掌握空间交会对接技术、开展地球观测活动奠定了基础。我国制造航天飞船的主要材料是铝,因而其也被称为会飞的金属,请根据其性质回答下列问题:
(1)现在工业冶炼铝的化学方程式为 。
(2)铝锂合金是今年来航空金属材料中发展最为迅速的一个领域,主要因为合金的某些性能优于各成分金属,其中包括 、 等方面。同时铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,LiAlH4在化学反应中通常作
(填“氧化”或“还原”)剂。
(3)铝电池性能优越,在现代生产、生活中有广泛的应用。
①Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”),
②铝一空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。

该电池的负极反应方程式为 ;正极反应方程式为 ;
电池中NaCl溶液的作用是 ;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应式为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池中Zn为负极,发生还原反应
B.该电池的正极反应式为MnO2+e-+H2O=2MnOOH+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时内电路中OH-移动向MnO2一极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
25℃时,在饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO,下列叙述中正确的是( )
H++Cl-+HClO,下列叙述中正确的是( )
A.用pH试纸测得溶液pH<7
B.向其中加入AgNO3溶液,平衡向右移,溶液的pH变小
C.向其中加入NaOH使pH=7,所得溶液中微粒浓度的关系如下:c(Na+)>c(Cl-)>c(ClO-)=c(HClO)
D.若氯水久置pH会逐渐增大
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上月考三化学试卷(解析版) 题型:填空题
重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示FeO·Cr2O3,还含有 SiO2、 Al2O3 等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:
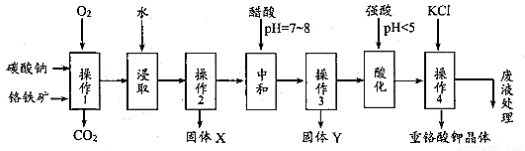
请回答下列问题:
操作1中发生的反应有:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
Na2CO3+Al2O3 2NaAlO2+CO2↑;Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是____________。
(2)固体Y 中主要含有______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式______________________。
(4)操作 4 中的化学反应在溶液中能发生的可能理由是_________________________;获得 K2Cr2O7 晶体的操作依次是:加入KCl 固体,在水浴上加热浓缩至______________,冷却结晶,抽滤,洗涤,干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:称取重铬酸钾试样 1.470g,用100mL 容量瓶配制成溶液。移取25.00mL 溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为 Cr3+),放于暗处 5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L 标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-;则所测产品中重铬酸钾的纯度为_____________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是_________.
A.粗产品若要进一步提纯,可以采用重结晶的方法
B. 配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考五化学试卷(解析版) 题型:选择题
某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解 溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O
溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e?+5OH? =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上段考三化学试卷(解析版) 题型:选择题
已知热化学方程式:H2(g)+2ICl(g)=2HCl(g)+I2(g) △H = a kJ·mol-1。其反应过程如下:
①H2(g)+ICl(g)=HClI(g)+H(g) (慢)
②H(g)+ICl(g)=HCl(g)+I(g) (快)
③HClI(g)=HCl(g)+I(g) (快)
④I(g)+I(g)=I2(g) (快)
下列说法不正确的是( )
A.总反应的速率由反应①的速率决定
B.反应④的焓变小于0
C.HClI是上述总反应的催化剂
D.正反应活化能Ea1与逆反应活化能Ea2之差为a kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com