
| 组别 | 甲 | 乙 | 丙 |
| A | Al2O3 | HNO3 | NaOH |
| B | N2 | O2 | NH3 |
| C | SiO2 | KOH | HF |
| D | SO2 | Ba(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al2O3与HNO3、NaOH均反应,且HNO3与NaOH反应;
B.O2与N2、NH3反应,但N2、NH3二者不反应;
C.SiO2与KOH、HF反应,且KOH与HF反应;
D.SO2与Ba(OH)2、NaHCO3反应,且Ba(OH)2与NaHCO3反应.
解答 解:A.Al2O3与HNO3反应生成硝酸铝和水,Al2O3与NaOH溶液反应生成偏铝酸钠和水,且HNO3与NaOH反应生成硝酸钠和水,组内任意两种物质在一定条件下均能发生反应,故A不选;
B.氮气与氧气反应生成一氧化氮,NH3与O2发生氧化还原反应生成NO和水,但N2、NH3二者不反应,则不满足组内任意两种物质在一定条件下均能发生反应,故B选;
C.SiO2与KOH反应生成硅酸钾和水,SiO2与HF反应生成四氟化硅和水,且KOH与HF反应生成KF和水,组内任意两种物质在一定条件下均能发生反应,故C不选;
D.SO2与Ba(OH)2反应生成亚硫酸钡和水,SO2与NaHCO3反应生成亚硫酸钠和二氧化碳,且Ba(OH)2与NaHCO3反应生成碳酸钡,组内任意两种物质在一定条件下均能发生反应,故D不选.
故选B.
点评 本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:实验题
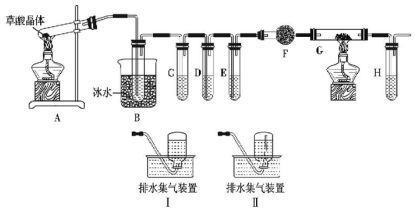
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
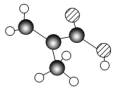 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O?H3O++OH- | B. | H2S?H++HS- | C. | NaHS=Na++HS- | D. | HCO3-=H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
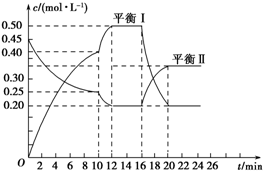 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③④⑥ | C. | ②③④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
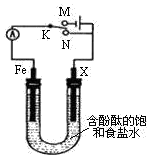
| A. | 电键K置于N处,若X为铜棒,可实现铁棒免受腐蚀 | |
| B. | 电键K置于N处,若X为锌棒,铁棒上发生的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 电键K置于M处,若X为碳棒,碳棒附近溶液变红 | |
| D. | 电键K置于M处,若X为铜棒,可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2有毒,可以用作某些食品防腐剂 | |
| B. | 铅笔芯的原材料为铅,儿童使用时如果用嘴吮吸能够引起铅中毒 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 | |
| D. | 科学家推测月尘[即月球上直径小于10μm(1μm=1×10-6m)的浮尘]是“玉兔号”出现控制异常情况的主要原因,月尘分散在空气中形成的分散系属于胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com