
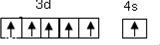
 ��
��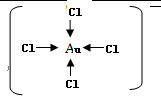 ��
������ ��1����Ԫ�����ڱ��У�Cu��Ag��Auλ�ڢ�B�塢���ܼ���������ȼ۵���ͨʽΪ��n-1��d10ns1��ͭԪ���������ڼ�Ϊ���������У���̬ԭ��δ�ɶԵ���������ԭ��Ϊ��ԭ�ӣ��ݴ˴��⣻
��2���ٷ����γ���������������ʵ��۷е㣻
����H��C��N��O�У���һ����������Ԫ��ΪN���縺������Ԫ��ΪO�����ݼ۲���ӶԻ������ۣ������йµ��Ӷ���Խ�࣬����ԽС���ݴ˴��⣻
��3��[AuCl4]-�У�ÿ���������������֮�䶼�γ�һ����λ�����ݴ˿ɻ����ṹʽ��
��4���Ͻ�ľ���Ϊ���������ṹ����ԭ��λ�����ģ���ԭ��λ�ڶ��㣬���Ծ�������ԭ����Ϊ6��$\frac{1}{2}$=3����ԭ����Ϊ8��$\frac{1}{8}$=1��
��5��ͭ�������백�����γ�ͭ��������ӣ�����Cu��OH��2������Ũ��ˮ���ݴ˴��⣮
��� �⣺��1����Ԫ�����ڱ��У�Cu��Ag��Auλ�ڢ�B�塢���ܼ���������ȼ۵���ͨʽΪ��n-1��d10ns1��ͭԪ���������ڼ�Ϊ���������У���̬ԭ��δ�ɶԵ���������ԭ��Ϊ��ԭ�ӣ���۲���ӹ��ʾ��ͼΪ ��
��
�ʴ�Ϊ����n-1��d10ns1�� ��
��
��2����CH3CH2OH����֮���γ����������CH3CH2OH�ķе����CH3CHO�ķе㣬
�ʴ�Ϊ��CH3CH2OH����֮���γ������
����H��C��N��O�У���һ����������Ԫ��ΪN���縺������Ԫ��ΪO��������ɵĻ�����Ļ�ѧʽΪN2O��NO��N2O3��NO2��N2O4��N2O5�����ݼ۲���ӶԻ������ۣ������йµ��Ӷ���Խ�࣬����ԽС��CH4��NH3��H2O������C��N��O�ŵ��Ӷ�������Ϊ0��1��2������CH4��NH3��H2O���ӵļ������μ�С��
�ʴ�Ϊ��N2O��NO��N2O3��NO2��N2O4��N2O5��CH4��NH3��H2O��
��3��[AuCl4]-�У�ÿ���������������֮�䶼�γ�һ����λ����������4����λ������ṹʽΪ ��
��
�ʴ�Ϊ��4�� ��
��
��4���Ͻ�ľ���Ϊ���������ṹ����ԭ��λ�����ģ���ԭ��λ�ڶ��㣬���Ծ�������ԭ����Ϊ6��$\frac{1}{2}$=3����ԭ����Ϊ8��$\frac{1}{8}$=1����ѧʽΪ��Ag3Au��AuAg3��
�ʴ�Ϊ��Ag3Au��AuAg3��
��5��ͭ�������백�����γ�ͭ��������ӣ�����Cu��OH��2������Ũ��ˮ����Ӧ�����ӷ���ʽΪCu��OH��2+4NH3•H2O=[Cu��NH3��4]2++2OH-+4H2O��
�ʴ�Ϊ��Cu��OH��2+4NH3•H2O=[Cu��NH3��4]2++2OH-+4H2O��
���� ���⿼����ۺϣ��漰�����Ų�ʽ���۷е�ıȽϡ�������ԭ��Ӧ�������ļ����֪ʶ�㣬�����ܶȹ�ʽ��������ԭ��Ӧԭ����֪ʶ������������ѵ��Ǿ����ļ��㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10mL��������Ϊ98%��H2SO4��10mLˮϡ�ͺ�H2SO4��������������49% | |
| B�� | �ڱ�״���£���11.2 L��������500mLˮ�У��õ�1mol•L-1�İ�ˮ | |
| C�� | ����0.1 mol•L-1��Na2CO3��Һ480mL������500ml����ƿ | |
| D�� | ��2�ȷݲ����͵��ռ���Һ�зֱ����һ������Na2O2��Na2O��ʹ��Һ��ǡ�ñ��ͣ�������Na2O2��Na2O�����ʵ���֮�ȵ���1��1�������¶Ȳ��䣩 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ�ú����Ȼ��Ƶ���ѩ������������ĸ�ʴ | |
| B�� | ���ڳ����ڱ�����������һ�ַ�ɢϵ��������̼���ֵ�ԭ������������ | |
| C�� | �����������°��������ȳ������������������������Ա����������� | |
| D�� | �ҹ����ֳ������ƹ�ʹ�õġ��״����͡��н����ŷŷ������ŵ㣬���κθ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | x=0.4a��2Fe2++Cl2=2Fe3++2Cl- | |
| B�� | x=1.5a��2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- | |
| C�� | x=a��2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D�� | x=0.6a��2Br-+Cl2=Br2+2Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HDO��H2O��ѧ���ʲ�ͬ | |
| B�� | ��Ư�۾��ͽ���飨��Ҫ�ɷ������ᣩ��Ϻ��Ũ��Һ��ϴ��ͰЧ������ | |
| C�� | ��ҵ��������Ļ�ѧ��Ӧ��ԭ�������ʴﵽ100%�ķ�Ӧ | |
| D�� | ��ԭ�ӵķ�����ζ����Ԫ�صĺϳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Li��Na��K | B�� | Na��Mg��Al | C�� | Li��Be��Mg | D�� | Li��Na��Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Ȼ�̼��Һ | B�� | ��������Һ�巴Ӧ | ||
| C�� | ��ȼ | D�� | ��һ���������������ӳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
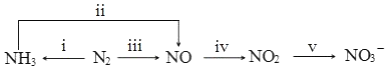
 ��
��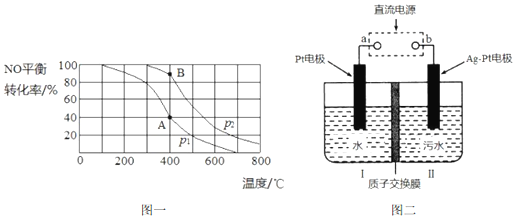
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ü��������ˮ�����˵ķ�����ȥNaCl��Һ�л��е�AlCl3 | |
| B�� | ��ȥNaCl��Һ��������Na2S������AgCl���ٹ��� | |
| C�� | ��MgCl2��Һ�м���CaCO3��ĩ����ֽ������˿ɳ�ȥ����FeCl3 | |
| D�� | ��ȥFeCl3��Һ��������CuCl2�������������ۣ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com